


 .
. ;
; .
.分析 结合题目信息再采用逆推法,E与C发生缩骤反应生成尼龙-66,由尼龙-66的结构简式可推知C为HOOC-(CH2)4-COOH,E为H2N-(CH2)6-NH2,1,3-丁二烯与氯气发生1,4-加成得A为CH2Cl-CH=CH-CH2Cl,A与HCN发生取代反应生成NCCH2CH=CHCH2CN,NCCH2CH=CHCH2CN与氢气加成得E,对比B的分子式可知,环已烷被氧化生成B为 ,B被氧化生成环已酮,环已酮与硝酸反应生成C,C与氨气反应生成D为NH4OOC(CH2)4-COONH4,D脱去水得NCCH2CH2CH2CH2CN,以苯为原料合成
,B被氧化生成环已酮,环已酮与硝酸反应生成C,C与氨气反应生成D为NH4OOC(CH2)4-COONH4,D脱去水得NCCH2CH2CH2CH2CN,以苯为原料合成 ,可以用苯与氯气发生取代,再碱性水解、酸化,再与氢气加成可得
,可以用苯与氯气发生取代,再碱性水解、酸化,再与氢气加成可得 ,据此答题.
,据此答题.
解答 解:结合题目信息再采用逆推法,E与C发生缩骤反应生成尼龙-66,由尼龙-66的结构简式可推知C为HOOC-(CH2)4-COOH,E为H2N-(CH2)6-NH2,1,3-丁二烯与氯气发生1,4-加成得A为CH2Cl-CH=CH-CH2Cl,A与HCN发生取代反应生成NCCH2CH=CHCH2CN,NCCH2CH=CHCH2CN与氢气加成得E,对比B的分子式可知,环已烷被氧化生成B为 ,B被氧化生成环已酮,环已酮与硝酸反应生成C,C与氨气反应生成D为NH4OOC(CH2)4-COONH4,D脱去水得NCCH2CH2CH2CH2CN,
,B被氧化生成环已酮,环已酮与硝酸反应生成C,C与氨气反应生成D为NH4OOC(CH2)4-COONH4,D脱去水得NCCH2CH2CH2CH2CN,
(1)根据上面的分析可知,反应②为氧化反应,反应③为缩聚反应,
故答案为:氧化反应;缩聚反应;
(2)根据上面的分析可知,D为NH4OOC(CH2)4-COONH4,
故答案为:NH4OOC(CH2)4-COONH4;
(3)C为HOOC-(CH2)4-COOH,一种与C互为同分异构体,且能发生银镜反应,说明有醛基的化合物的结构简式为 ,
,
故答案为: ;
;
(4)反应①的化学方程式 ,反应②的化学方程式
,反应②的化学方程式 ,
,
故答案为: 、
、 ;
;
(5)B为 ,一定条件下,能与HCl发生取代反应,故选b;
,一定条件下,能与HCl发生取代反应,故选b;
(6)以苯为原料合成 ,可以用苯与氯气发生取代,再碱性水解、酸化,再与氢气加成可得,合成路线为
,可以用苯与氯气发生取代,再碱性水解、酸化,再与氢气加成可得,合成路线为 ,
,
故答案为: .
.
点评 本题着力考查阅读有机合成方案、利用题设信息、解决实际问题的能力,也考查了学生对信息接受和处理的敏锐程度、思维的整体性和对有机合成的综合分析能力,本题涉及到有机物性质、有机官能团,合成路线流程图设计与表达,重点考查课学生思维的敏捷性和灵活性,对学生的信息获取和加工能力提出较高要求,题目难度中等.


科目:高中化学 来源: 题型:解答题
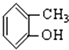 ⑥
⑥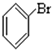 ⑦
⑦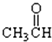 ⑧
⑧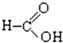 ⑨
⑨ ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
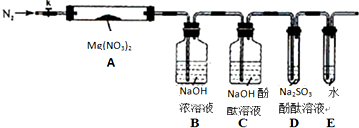
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含电子数相等 | |
| C. | 32gSO2和40gSO3所含的原子数相等 | |
| D. | 标准状况下,11.2LCO2与常温常压下17gNH3所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
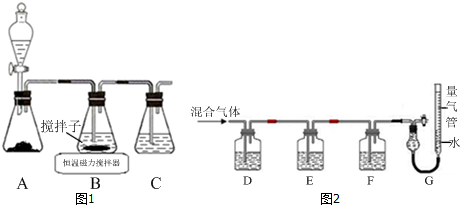
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
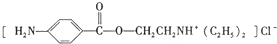 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: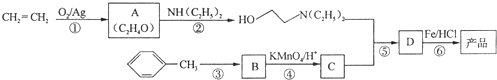
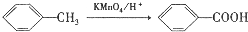
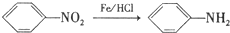

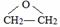 .
.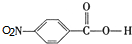 ,C中含有的含氧官能团的名称为硝基、羧基.
,C中含有的含氧官能团的名称为硝基、羧基. +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$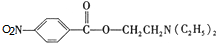 +H2O.
+H2O.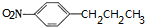 (任写一种).
(任写一种).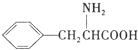 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
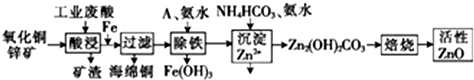
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.7 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 通入一定量氦气,压强增大,平衡向正反应方向移动 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com