
 ⑥
⑥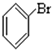 ⑦
⑦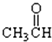 ⑧
⑧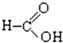 ⑨
⑨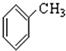 ⑩
⑩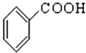
分析 ①CH3CH2OH含-OH,且-OH与脂肪烃基相连,为醇;
②CH3COCH3含羰基,为酮类物质;
③CH3CH2Br中含-Br,为卤代烃;
④CH3COOCH2CH3中含-COOC-,为酯类物质;
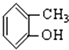
⑤ 中含酚-OH,为酚类物质;
中含酚-OH,为酚类物质;
⑥ 含-Br,为卤代烃;
含-Br,为卤代烃;
⑦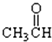 中含-CHO,为醛类物质;
中含-CHO,为醛类物质;
⑧ 中含-COOH,为羧酸;
中含-COOH,为羧酸;
⑨ 含苯环,且只含C、H元素,为芳香烃;
含苯环,且只含C、H元素,为芳香烃;
⑩ 中含-COOH,为羧酸,以此来解答.
中含-COOH,为羧酸,以此来解答.
解答 解:官能团决定物质的性质,由官能团可知物质的类别,则
(1)含C、H元素且有苯环的为芳香烃,只有⑨符合,故答案为:⑨;
(2)含C、H、X的为卤代烃,③⑥符合,故答案为:③⑥;
(3)含-OH且与脂肪烃基相连的为醇,①符合,故答案为:①;
(4)含-OH且与苯环直接相连的为酚,⑤符合,故答案为:⑤;
(5)含-CHO的为醛,⑦符合,故答案为:⑦;
(6)含羰基的为酮,②符合,故答案为:②;
(7)含-COOH的为羧酸,⑧⑩符合,故答案为:⑧⑩;
(8)含-COOC-的为酯,④符合,故答案为:④.
点评 本题考查有机物的官能团及分类,为高频考点,把握常见有机物的组成、官能团及类别等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
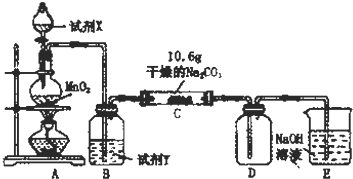
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
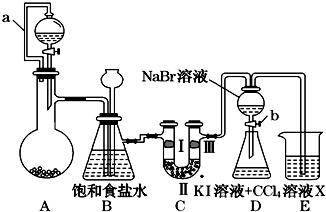
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
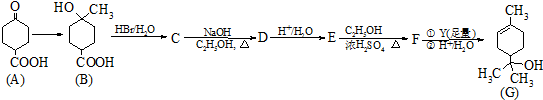
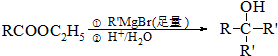
 .
.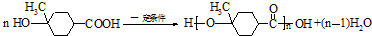 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | |
| C. | 加入AgNO3溶液时首先生成AgCl沉淀 | |
| D. | 混合溶液中$\frac{c(C{l}^{-})}{c({I}^{-})}$约为1.03×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
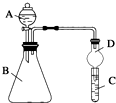 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


 .
. ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com