
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:

已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
【答案】除去废料中的有机物;使部分金属单质转化为氧化物 漂液 节约成本,不影响后续操作 2Fe2++ClO-+2H+=2 Fe3++Cl-+H2O 5 Na2CO3 NiCO3+H2O![]() Ni(OH)2+CO2↑ 2 Ni(OH)2+OH--e-=NiOOH +H2O
Ni(OH)2+CO2↑ 2 Ni(OH)2+OH--e-=NiOOH +H2O
【解析】
铁触媒废料焙烧,可以将部分金属单质转化为金属氧化物以及使有机物燃烧而除去,焙烧后固体和硫酸反应生成硫酸盐;再将Fe2+氧化成Fe3+,氧化剂选择漂液(因为漂液价格低廉,且不影响后续实验)。然后调节pH使Fe3+、Al3+一起转化为氢氧化物沉淀而除去。滤液1中还有Zn2+、Cu2+以及Ni2+,加入NiS,可以除去Zn2+、Cu2+。滤液2中有镍离子,同样的道理,在沉淀Ni2+的时候,选择碳酸钠,它的价格也是比较低,加入碳酸钠后得到碳酸镍;碳酸镍加水煮沸会转化成Ni(OH)2,最后Ni(OH)2灼烧分解,就可以得到氧化镍。
(1)焙烧可以使部分金属单质变成金属氧化物,并且能够使有机物燃烧并除去。所以“焙烧”的目的为:除去废料中的有机物;使部分金属单质转化为氧化物;
(2)应选择氧化剂使亚铁离子氧化成铁离子,氧化剂包括了漂液和双氧水,但是双氧水的价格更贵,所以选择漂液;选择漂液的理由就是漂液成本更低,而且生成NaCl也不影响后续操作。
(3)漂液中含有NaClO,将Fe2+氧化成Fe3+,ClO-被还原成Cl-,反应的离子方程式为![]() ;
;
(4)Fe(OH)3和Al(OH)3类型相同,Fe(OH)3 的Ksp比Al(OH)3小,为了使它们完全沉淀,用Al(OH)3的Ksp进行计算, 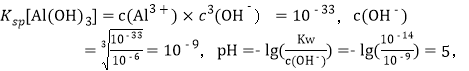 则pH至少为5;
则pH至少为5;
(5)需要选择沉淀Ni2+的沉淀剂,NaOH的价格更贵,所以选择Na2CO3,根据题意,加入Na2CO3时,生成的滤渣2为NiCO3,NiCO3加水煮沸转化成Ni(OH)2,加水煮沸的方程式为NiCO3+H2O![]() Ni(OH)2+CO2↑。
Ni(OH)2+CO2↑。
(6)镍氢电池放电时负极的是MH,在反应中MH变成了M,失去质量为H的质量,负极反应式为MH-e-+OH-=M+H2O,转移2mol,负极质量减少2g;充电时阳极发生氧化反应,化合价升高,Ni(OH)2变成NiOOH,电极反应式为:Ni(OH)2+OH--e-=NiOOH +H2O。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)据媒体报道,挪威和荷兰正在开发一种新能源盐能。当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%。海水和淡水混合时,温度升高最可能的原因是______。
A.发生了盐分解反应
B.发生了水分解反应
C.由于浓度差产生放热
D.盐的溶解度增大
(2)蒸馏法是人类最早使用的淡化海水的方法。你认为蒸馏法淡化海水最理想的能源是_______。
(3)从海水中可得到多种化工原料和产品,如图是利用海水资源的流程图。

①反应Ⅱ的离子方程式为_________。
②从反应Ⅲ后的溶液中得到纯净的单质溴的实验操作方法是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图(铁架台、铁夹、酒精灯等未画出):

取17.1 g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的______________________。
(2)C装置的作用是_____________________________。D装置的作用是_____________________。
(3)通过该实验,能否确定A中是否含有氧原子?__________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.90 g,D装置增重26.4 g,则A的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol) P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2![]() P4O6
P4O6

A. 放出1 638 kJ热量
B. 吸收1 638 kJ热量
C. 放出126 kJ热量
D. 吸收126 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是

A. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
B. 生成1mol H2O时吸收热量245kJ
C. H2O分解为H2与O2时放出热量
D. 氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下表中各项的排布规律,按此规律排布第26项应为( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
A. C7H16B. C7H14O2C. C8H18D. C8H18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A (C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
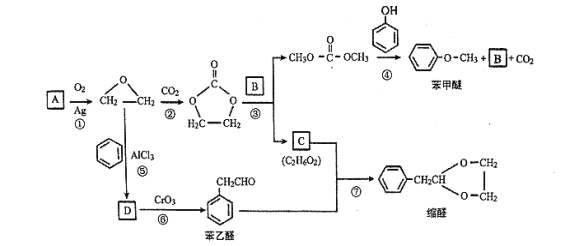
已知:![]()
回答下列问题:
(1)B的分子式是_______,C中含有的官能团名称是_______。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为_______,⑥的反应类型是_______。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:_______。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_______。
i .含有苯环和结构![]()
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有_______ (不考虑立体异构)种。
(6)参照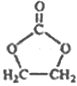 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备 的合成流程图:_______。
的合成流程图:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取三份锌粒,放入三只烧杯中,然后在甲、乙两只烧杯中分别加入2mol/L的盐酸、稀硫酸各45mL,丙烧杯中加入刚刚用5mL18mol/L的浓硫酸稀释而成的45mL稀硫酸溶液,若反应终止时,生成的气体一样多,且锌粒没有剩余。
(1)参加反应的锌的质量:甲___________乙_________丙(填“>”、“<”、“=”,下同)。
(2)反应速率,甲__________乙,原因是___________。
(3)反应完毕 所需时间:乙____________丙,原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com