
下列事实中,能够证明HCl是共价化合物的是
| A.HCl易溶于水 | B.液态的HCl不导电 |
| C.HCl不易分解 | D.HCl溶于水能电离,呈酸性 |
B
解析试题分析:共价化合物的构成微粒不带电,则液态不导电。但离子化合物的构成微粒带电,其液态能导电,以此来证明氯化氢是共价化合物。
A、不能利用溶解性判断是否为共价化合物,如NaCl也易溶于水,但属于离子化合物,故A错误;
B、因共价化合物的构成微粒不带电,离子化合物的构成微粒带电,则可利用液态氯化氢不导电来证明氯化氢是共价化合物,故B正确;
C、不能利用分解来判断是否为共价化合物,如NaCl受热也不易分解,但属于离子化合物,故C错误;
D、氯化氢溶于水,溶液显酸性,不能作为判断是否为共价化合物的依据,例如硫酸氢钠溶于水也显酸性,而硫酸氢钠是离子化合物,故D错误,答案选B。
考点:考查共价化合物的判断
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生能力的培养和解题方法的指导与训练。有利于培养学生的逻辑思维能力和逆向思维能力。明确共价化合物的构成微粒是解答本题的关键。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下表是一些共价键的键能(kJ/mol)数据, 以下表达中肯定正确的是
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-Cl | 330 | H-Se | 314 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.分子中键能越大,键长越长,则分子越稳定 |
| B.元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间不能形成共价键 |
| C.水分子可表示为HO—H,分子中键角为180° |
| D.H—O键键能为463 kJ·mol-1,即18gH2O分解成H2和O2时,消耗能量为926kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
近年来研制的NF3气体可用作氟化氢—氟化氚高能化学激光器的氟源,也可作为火箭推进剂,NF3可用NH3与氟气制取,化学方程式为:4NH3+3F2=NF3+3NH4F,下列说法中不正确的是( )
A.NF3的形成过程用电子式可表示为 |
| B.NF3分子空间构型为三角锥形 |
| C.NF3的氧化性大于F2 |
| D.NH4F中既有离子键又有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)有下列物质:①CO2 ②N2 ③H2O2 ④NH3 ⑤Ca(OH)2 ⑥Na2O2 ⑦NH4Cl,试用以上物质的序号填空:
(1)既有极性键,又有非极性键的是______________;
(2)既有离子键,又有非极性键的是______________;
(3)属于共价化合物的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(5分)元素Cu的一种氯化物晶体的晶胞结构如图所示,计算推出该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为____________________。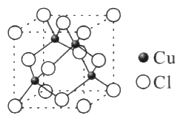
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为 。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为 。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ,中心原子杂化类型为 。
(5)①HClO4、②HIO4、③H5IO6〔可写成(HO)5IO〕的酸性由强到弱的顺序为 (填序号)。
(6)IBr和水能发生反应,生成物中有一种为三原子分子,写出该化合物的结构式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com