
 3C��g������֪����1molA��3molB��ƽ��ʱA�����ʵ���Ϊa mol��
3C��g������֪����1molA��3molB��ƽ��ʱA�����ʵ���Ϊa mol�� 3C��g�� ���ʵ������١�n
3C��g�� ���ʵ������١�n ×100%=
×100%=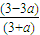 ×100%��
×100%�� ×100%��
×100%��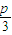 =1�� m+p=31��������m=3n
=1�� m+p=31��������m=3n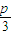 =1��m+p=31��m=3n��
=1��m+p=31��m=3n��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2C��g������ʼ����1molA��2molB����Ӧ�ﵽƽ�����C��Ũ��Ϊp mol/L����C���������Ϊ�أ�����ͬ�����£�
2C��g������ʼ����1molA��2molB����Ӧ�ﵽƽ�����C��Ũ��Ϊp mol/L����C���������Ϊ�أ�����ͬ�����£�| 1 |
| 2 |
| 1 |
| 2 |
 2SO3��g����������Ӧ�Ƿ��ȷ�Ӧ�����ﵽƽ���������������ʱ��ֻ�ı����е�ijһ�����������仯�����������С�����䣩����ո��У�
2SO3��g����������Ӧ�Ƿ��ȷ�Ӧ�����ﵽƽ���������������ʱ��ֻ�ı����е�ijһ�����������仯�����������С�����䣩����ո��У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧѧ���е�ƽ��������Ҫ���ݰ�������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ������֣��Ҿ�������������ԭ������ش��������⣮
��ѧѧ���е�ƽ��������Ҫ���ݰ�������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ������֣��Ҿ�������������ԭ������ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
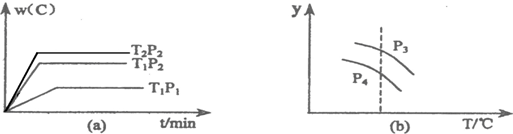
| A��P3��P4��y���ʾA��ת���� | B��P3��P4��y���ʾB��������� | C��P3��P4��y���ʾ��������ƽ����Է������� | D��P3��P4��y���ʾ���������ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��a��b��c=m��n��p | ||||||
B��a��b=m��n��
| ||||||
C��
| ||||||
D��a=
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com