
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| K(CO).C(H2O) |
| C(CO2).C(H2) |
| K1 |
| K2 |
| K(CO).C(H2O) |
| C(CO2).C(H2) |
| K(CO).C(H2O) |
| C(CO2).C(H2) |
| K1 |
| K2 |
| K1 |
| K2 |


科目:高中化学 来源: 题型:
 2NH3是工业上合成氨的重要反应.
2NH3是工业上合成氨的重要反应.
 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol| 16 |
| a2 |
| 16 |
| a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| [CO][H2O] |
| [H2][CO2] |
| [CO][H2O] |
| [H2][CO2] |
| K1 |
| K2 |
| K1 |
| K2 |
查看答案和解析>>
科目:高中化学 来源:2014届浙江临海市高一下学期期末模拟化学试卷(解析版) 题型:填空题
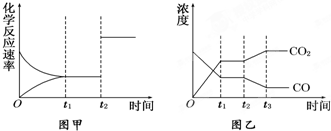
(8分)某研究性学习小组为探究纯铁与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:

实验①:把纯铁片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)若要加快化学反应速率,除实验②的方法外,还可以采取哪些措施?(至少写两点)
、
(3)某同学认为实验②反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验②中原电池的正、负极电极反应式。
(4)已知热化学方程式Fe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)↑ ; △H= —42kJ/mol,28g的铁完全反应后放出的热量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com