
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加 热到1500 ℃生成白磷,反应为:
热到1500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸 钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I-
2S2O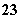 +I2===S4O
+I2===S4O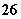 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol·L-1I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO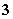 +5SO
+5SO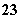 +2H+===I2+5SO
+2H+===I2+5SO +H2O
+H2O
生成 的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1Na2SO3溶液的体积/mL | H2O的 体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
该实验的目的是________________________________________________________________________;
表中V2=________mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的 蕴藏量居世界首位。
蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是__________________________________________
_________________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3。Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O===Ce(OH)4↓+______
【答案】

【解析】 (1)P元素为15号元素,根据核外电子排布规律其原子结构示意图为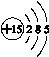 。
。
(2)在P4O10中P的化合价为+5价,当生成1 mol P4转移电子数为20 mol。
(3)第二个反应消耗Na2S2O3的物质的量为:b mol·L-1×V2 10-3L=V2b10-3mol,则第一个反应剩余的I2的物质的量为0.5V2b10-3mol,该过程加入I2总的物质的量为a mol·L-1×V1 10-3L=V1 a 10-3mol,则参加第一个反应的I2的物质的量为V1a 1 0-3mol-0.5 V2b 10-3mol,则该溶液中维生素C的物质的量为V1a 10-3
0-3mol-0.5 V2b 10-3mol,则该溶液中维生素C的物质的量为V1a 10-3 mol-0.5 V2b 10-3mol=(V1a-0.5 V2b)10-3mol。
mol-0.5 V2b 10-3mol=(V1a-0.5 V2b)10-3mol。
(4)实验1和实验2温度相同但加水体积不同,而实验2和实验3温度不同则加水体积应该相同,故V2=40,有3个实验所给出的不同对比数据可得出该实验目的为:探究该反应的速率与温度、亚硫酸钠浓度的关系。
(5)CeCl3发生水解的方程式为:CeCl3+3H2OCe(OH)3+3HCl,NH4Cl固体加热可分解生成HCl,起到抑制CeCl3水解的作用。
(6)根据电荷守恒:反应物中有阳离子,则生成物中必然要有阳离子,由题意知溶液pH=3,故最后一个空应为H+;根据氧化还原反应方程式的配平原则,分析反应中的化合价变化,H2O2中两个O的化合价从-1→ -2,得到2个电子,Ce元素的化合价从+3→+4,
-2,得到2个电子,Ce元素的化合价从+3→+4, 应该失去两个电子,综合得失电子守恒和质量守恒,可配平出2Ce3++H2O2+6H2O===2Ce(OH)4+6H+
应该失去两个电子,综合得失电子守恒和质量守恒,可配平出2Ce3++H2O2+6H2O===2Ce(OH)4+6H+


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
在下列①~⑩中选出适宜的词语填入下列每小题的空格中(填编号):
①渗析 ②盐析 ③聚沉 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳
⑧丁达尔现象 ⑨中和 ⑩水解
(1)肥皂水中透过强光,可以见到光亮的“通路”。这种现象称为___________。
(2)在制取肥皂时,加入食盐细粒使肥皂析出,这个过程称为_____________。
(3)在肥皂水中滴加酚酞,溶液变成红色,说明高级脂肪酸根离子发生了____________。
(4)在氢氧化铁胶体中加入浓硫酸铵溶液,产生红褐色沉淀,这种现象叫做___________。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92 g的NO 2和N2O4混合气体含有的原子数为6NA
2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.1.00mol NaCl中含有6.02×1023个NaCl分子
B. 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配置1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
设 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.常温下, 的
的 溶液中氮原子数为0.2
溶液中氮原子数为0.2
B.1mol羟基中电子数为10
C.在反应中,每生成3mol 转移的电子数为6
转移的电子数为6
D.常温常压下,22.4L乙烯中 键数为4
键数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.24 g镁的原子最外层电子数为NA
B.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1NA
C.1 mol甲烷分子所含质子数为10NA
D.标准状况下,22.4 L乙醇的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在三个密闭容器中分别充入Ne,H2,O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2) B.p(O2)> p(Ne)> p(H2)
C. p(H2)> p(O2)> p(Ne) D. p(H2)> p(Ne)> p(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样
品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。
下图所示的是用燃烧法确定有机物分子式的常用装置。


现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧
后A管增重0.88 g,B管增重0.36g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是(装置不重复)



 D F;
D F;
(2)A、B管内均盛有固态试剂,A管的作用是
______________________________;
(3)该有机物的实验式为__________________;
(4)如果把CuO网去掉,A管重量将_________;(填“增大”、“减小”、或
“不变”)
(5)要确定该有机物的分子式,还必须知道的数据是___________。
① 消耗液体H2O2的质量 ②样品的摩尔质量 ③ CuO固体减少的质量 ④ C装置增加的质量 ⑤ 燃烧消耗O2的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com