
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92 g的NO 2和N2O4混合气体含有的原子数为6NA
2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
存放下列试剂的方法中,有错误并且会引起危险的是 ( )
A.白磷浸在盛有CS2的敞口试剂瓶中 B.金属钠浸在盛有煤油的试剂瓶中
C.浓硝酸存放在棕色试剂瓶中 D.溴水放在带橡皮塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.含有NA个氦原子的氦气在标准状况下的体积约为22.4 L
B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D.标准状况下,11.2 L H2O含有的分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏伽德常数的数值,下列说法正确的是( )
A.18 g H2O含有10nA个质子
B.1 mol甲苯含有6nA个C—H键
C.标准状况下,22.4 L氨水含有nA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成nA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
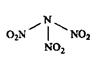
A.分子中N、O间形成的共价键是非极性键
B.分子中四个氮原子共平面
C.该物质既有氧化性又有还原性
D.15.2 g该物质含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加 热到1500 ℃生成白磷,反应为:
热到1500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10
10C+P4O10===P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
(3)硫代硫酸 钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I-
2S2O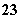 +I2===S4O
+I2===S4O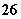 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol·L-1I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是________mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO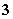 +5SO
+5SO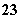 +2H+===I2+5SO
+2H+===I2+5SO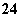 +H2O
+H2O
生成 的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1Na2SO3溶液的体积/mL | H2O的 体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
该实验的目的是________________________________________________________________________;
表中V2=________mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的 蕴藏量居世界首位。
蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是__________________________________________
_________________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3。Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O===Ce(OH)4↓+______
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是 :
:
A.标准状况下,5.6 L四氯化碳含有的分子数为0.25 NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子 总数均为NA
总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C4H8O2的有机物在酸性条件下水解为酸和醇。若不考虑立体异构,
这些酸和醇重新组合可形成的酯共有
A.3种 B.6种 C.9种 D.12种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com