
根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是
A.厕所清洁剂 醋 肥皂 厨房清洁剂
B.醋 厕所清洁剂 肥皂 厨房清洁剂
C.厕所清洁剂 厨房清洁剂 醋 肥皂
D.厨房清洁剂 醋 肥皂 厕所清洁剂
科目:高中化学 来源:2014-2015学年湖南益阳市高二上学期10月月考化学试卷(解析版) 题型:选择题
一种气态烷烃与一种气态炔烃等体积混合,测得混合气体在标准状况下的密度为1.25g/L,则构成这种混合气体的烷烃和炔烃可能是
A、甲烷,乙炔 B、甲烷,丁炔 C、乙烷,乙炔 D、乙烷,丙炔
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北鄂州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列对实验现象的描述中错误的是
A.向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅
B.向5mL0.1mol/LK2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色
C.等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快
D.酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试试化学试卷(解析版) 题型:填空题
化学反应原理是探索化学反应内在的规律,是化学的精髓所在,也是化学的魅力所在。请利用化学反应原理的相关知识回答下列问题。
(1)寝室楼梯口挂着红色的灭火器,其中有一种泡沫灭火器是利用碳酸氢钠溶液和硫酸铝溶液反应生成大量的二氧化碳来灭火。请写出该反应的离子方程式: 。
(2)学校运动场边的铁制护网容易生锈,可以利用电化学腐蚀的原理来解释这一现象。请写出钢铁发生吸氧腐蚀的正极反应式: 。
(3)学校的锅炉房一般会定期去除锅炉水垢。水垢中含有的CaSO4,可先用Na2CO3溶液处理,而后用酸去除。请用一个离子方程式表示Na2CO3的作用: 。
(4)我们所使用的自来水一般要经过杀菌消毒处理,其中Cl2也曾用于自来水的消毒。工业上常用电解饱和食盐水的方法制取Cl2,请写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试试化学试卷(解析版) 题型:选择题
已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是
A.NaX NaY NaZ B.NaX NaZ NaY
C.NaY NaZ NaX D.NaZ NaY NaX
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高一上学期期中化学试卷(解析版) 题型:计算题
(6分)黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为 。
(2)已知 (炉渣),产物Cu2S在1200℃高温下继续反应:
(炉渣),产物Cu2S在1200℃高温下继续反应:
2Cu2S + 3 O2  2Cu2O + 2 SO2 ;2Cu2O + Cu2S
2Cu2O + 2 SO2 ;2Cu2O + Cu2S  6Cu + SO2
6Cu + SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量。
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜?
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高一上学期期中化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是
①生成42.0 L N2(标准状况)
②有0.250 mol KNO3被氧化
③转移电子的物质的量为1.25 mol
④被氧化的N原子的物质的量为3.75 mol
A.①② B.③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省高二上学期期中考试化学试卷(解析版) 题型:实验题
某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00 mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理 。
(2)从上述实验步骤中选出正确的并按操作先后排序。你的实验顺序为:(用字母表示) 。
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是________,滴定终点的现象是_________________________________。
(4)某同学实验后得到的数据如下:
滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
V(NaOH) /mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
V(NaOH) /mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
原白醋中醋酸的物质的量浓度为________mol/L(结果保留4位有效数字)。
(5)分析下列操作对测定结果的影响,用“偏低”、“偏高”或“不影响”填空。
①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡_______;
②读取标准溶液体积时,滴定前平视,滴定后仰视________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉新洲三中高二10月月考化学(A卷)试卷(解析版) 题型:实验题
某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。
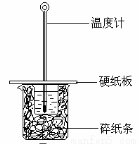
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)取50 mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
温度
次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.1 | 3.0 |
2 | 25.9 | 25.9 | 25.9 | 28.8 | |
3 | 26.4 | 26.2 | 26.3 | 29.4 | |
②近似认为0.55mol/L NaOH溶液和0.50 mol/L盐酸的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (结果保留小数点后一位)。
③氢氧化钠溶液稍过量的原因是 。
④上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是 (填字母)。
a. 实验装置保温、隔热效果差
b. 用量筒量取盐酸时俯视读数
c. 分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d. 用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com