
| A、将1mol?L-1 FeCl3溶液滴入沸水中制备Fe(OH)3胶体 |
| B、氢气还原氧化铜实验中,先通氢气后加热氧化铜 |
| C、将FeCl3稀溶液加热蒸发浓缩制备FeCl3浓溶液 |
| D、用烧瓶加热液体时投入碎瓷片以防暴沸 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 编号 | 物质(微粒) | 电离度α | ||||
| A | 硫酸溶液(第一步完全电离):第二步 HSO
|
10% | ||||
| B | 硫酸氢钠溶液:HSO
|
29% | ||||
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% | ||||
| D | 盐酸:HCl=H++Cl- | 100% |
- 4 |
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO42- |
| B、H2CO3的电离:H2CO3?2H++CO32- |
| C、Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- |
| D、Na2CO3的水解:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol/l |
| B、1.6mol/l |
| C、2mol/l |
| D、1.3mol/l |
查看答案和解析>>
科目:高中化学 来源: 题型:
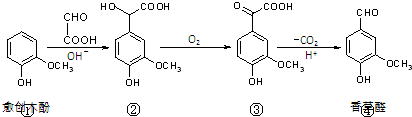 ( )
( )| A、在上述三步反应中理论上只有①生成②的反应原子利用率为100% |
| B、氯化铁溶液和碳酸氢钠溶液都能鉴别③④ |
| C、②分子中C原子不可能在同一平面上 |
| D、等物质的量的①②分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
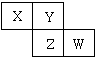 如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子最外电子层电子数是其内层电子数的
如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子最外电子层电子数是其内层电子数的| 7 |
| 10 |
| A、X元素的氢化物水溶液呈碱性 |
| B、气态氢化物的稳定性:Y>Z |
| C、最高氧化物对应水化物的酸性:W>Z |
| D、阴离子半径从大到小排列的顺序:Y>Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,有机物 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 |
| B、将1-溴丙烷和饱和氢氧化钾乙醇溶液共热,产生的气体通过酸性高锰酸钾溶液,溶液褪色,一定能证明1-溴丙烷发生了消去反应 |
C、纤维素  和壳聚糖 和壳聚糖 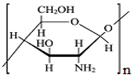 均属于多糖 均属于多糖 |
D、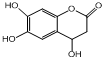 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L |
| B、0.02mol/L |
| C、0.05mol/L |
| D、0.15mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据交叉分类法,Na2SO4既是钠盐又是硫酸盐 |
| B、氧化还原反应中有一种元素化合价升高,必定有另一种元素化合价降低 |
| C、根据是否有丁达尔效应将分散系分为溶液、胶体和浊液 |
| D、稀H2SO4能导电,所以稀H2SO4是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com