
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下表所示,下列说法错误的是
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有利余、溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
D.实验Ⅱ、Ⅲ中加入蒸溜水后c(Cu2+)相同
【答案】D
【解析】
实验Ⅰ:少量铜粉加入1ml0.1mol/L氯化铁溶液,充分振荡,加2mL蒸馏水,铜粉少时,溶液黄色变浅,加入蒸馏水后无明显现象,说明铁离子氧化铜生成铜离子;
实验Ⅱ:过量铜加入1ml0.1mol/L氯化铁溶液,充分振荡,加2mL蒸馏水,铜粉有余,溶液黄色褪去,铁离子全部和铜反应,加入蒸馏水后生成白色沉淀说明铜被氧化产物有亚铜离子,生成CuCl白色沉淀;
实验Ⅲ:过量铜加入1ml0.05mol/L硫酸铁溶液,充分振荡,加2mL蒸馏水,铜粉有余,溶液黄色褪去,加入蒸馏水后无白色沉,说明铁离子反应完全,生成的溶液中可能含铜离子和亚铜离子,据此分析判断。
A.由分析可知,实验Ⅰ、Ⅱ、Ⅲ中溶液黄色变浅或褪去,均涉及Fe3+被还原,A项正确,不符合题意;
B.对比实验I、Ⅱ可知,白色沉淀CuCl的产生与铜粉的量有关,对比实验Ⅱ、III可知,白色沉淀CuCl的产生与溶液的阴离子种类有关,故B正确,不符合题意;
C.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液,可能出现白色CuCl沉淀,C项正确,不符合题意;
D.实验Ⅱ中有CuCl沉淀生成,实验Ⅲ中没有CuCl沉淀生成,因此加入蒸溜水后,c(Cu2+)不相同,D项错误,符合题意;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一些资料认为NO不能与Na2O2反应,某同学提出质疑,他认为NO易与O2发生反应,应该更容易被Na2O2氧化。査阅资料:
a.2NO+Na2O2=2NaNO2;
b.6NaNO2+3H2SO4(稀)=3Na2SO4+2HNO3+4NO↑+2H2O;
某同学用如图所示装置(部分夹持装置略),探究NO与Na2O2的反应。
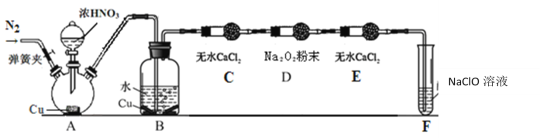
(1)请写出A中反应的化学方程式___。
(2)B中观察到的主要现象是___。
(3)在反应前,打开弹簧夹,通入一段时间N2,目的是___。
(4)充分反应后,检验D装置中发生反应的实验是___。
(5)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示:
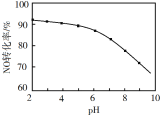
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO![]() ,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
,其离子方程式为___,若标准状况下16.8LNO被NaClO溶液完全吸收,则转移的电子的物质的量为___mol。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将24.4 g NaOH固体溶于水配成100 mL溶液,其密度为1.219 g/mL。
(1)该溶液中NaOH的物质的量浓度为________mol/L。
(2)该溶液中NaOH的质量分数为________。
(3)从该溶液中取出10 mL,其中NaOH的物质的量浓度为________ mol/L;含NaOH的物质的量为________。
(4)将取出的10 mL溶液加水稀释到100 mL,稀释后溶液中NaOH的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F用于制造香精,可利用下列路线合成。
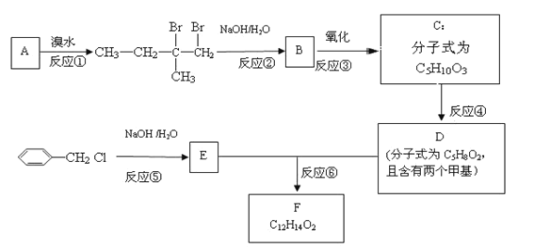
回答下列问题:
(1)A的化学名称是______________。
(2)B的结构简式是______________,D中官能团的名称是_____________。
(3)①~⑥中属于取代反应的有________________(填序号)。
(4)反应⑥的化学方程式为_________________________________________________。
(5)C有多种同分异构体,与C具有相同官能团的有_________种(不包括C),其中核磁共振氢谱为四组峰的结构简式为_________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变可使反应速率加快的是( )
A. 增加C的量
B. 将容器的体积减小一半
C. 保持体积不变,充入氮气使体系的压强增大
D. 保持压强不变,充入氮气使体系的体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如下反应得到
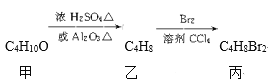
丙的结构简式不可能是( )
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如下图,下列说法正确的是
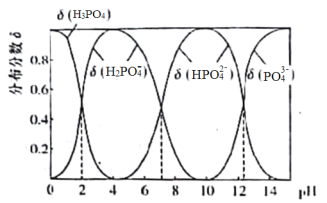

A.滴加NaOH溶液至pH=7,溶液中c(Na+)>c(H2PO4-)+c(HPO42—)+c(PO43—)
B.该温度下,H3PO4的三级电离常数Ka3>10-12
C.H3PO4的电离方程式为:H3PO4 3H+ + PO43—
D.滴加少量Na2CO3溶液,化学反应方程式为3 Na2CO3 + 2H3PO4=2Na2PO4+3H2O+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向NaHS溶液中加入盐酸产生大量气泡 | 氯的非金属性强于硫 |
B | 向溶液中加盐酸酸化的氯化钡溶液产生白色沉淀 | 原溶液中一定含 |
C | 将铁片和铜片用导线连接后插入浓硝酸,铁片表面产生气泡 | 铜的活泼性强于铁 |
D | 常温下测得CH3COONH4溶液pH=7 | 相同温度下CH3COOH和NH3·H2O电离常数相同 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种绿色晶体,易溶于水,难溶于乙醇等有机溶剂,光照或受热易分解。实验室要制备K3[Fe(C2O4)3]·3H2O并测定![]() 的含量。请回答下列相关问题。
的含量。请回答下列相关问题。
I.FeC2O4·2H2O的制备
向烧杯中加入5.0g(NH4)2Fe(SO4)2·6H2O、15mL蒸馏水、1mL3moL/L的硫酸,加热溶解后加入25mL饱和H2C2O4溶液,继续加热并搅拌一段时间后冷却,将所得FeC2O4·2H2O晶体过滤、洗涤。
(1)制备FeC2O4·2H2O时,加入3mol/L硫酸的作用是________________________。
II.K3[Fe(C2O4)3]·3H2O的制备
向I中制得的FeC2O4·2H2O晶体中加入10mL饱和K2C2O4溶液,水浴加热至40℃,缓慢加入过量3%的H2O2溶液并不断搅拌,溶液中产生红褐色沉淀,H2O2溶液完全加入后将混合物加热煮沸一段时间,然后滴加饱和H2C2O4溶液使红褐色沉淀溶解。向溶液中再加入10mL无水乙醇,过滤、洗涤、干燥。
(2)制备过程中有两个反应会生成K3[Fe(C2O4)3],两个化学方程式依次是:______________________、2Fe(OH)3+3K2C2O4+3H2C2O4=2K3[Fe(C2O4)3]+6H2O。
(3)H2O2溶液完全加入后将混合物加热煮沸一段时间的目的是______________________。
III.![]() 含量的测定
含量的测定
称取0.22gⅡ中制得的K3[Fe(C2O4)3]·3H2O晶体于锥形瓶中,加入50mL蒸馏水和15mL3mol/L的硫酸,用0.02000mol/L的标准KMnO4溶液滴定,重复3次实验平均消耗的KMnO4溶液体积为25.00mL。
(4)滴定时KMnO4溶液应盛放在_____________(填仪器名称)中,判断滴定终点的依据是_________________。
(5)滴定终点时,所得溶液中的溶质除硫酸外,还有__________________________(写化学式),K3[Fe(C2O4)3]·3H2O样品中![]() 的质量分数是____________________。
的质量分数是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com