
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下: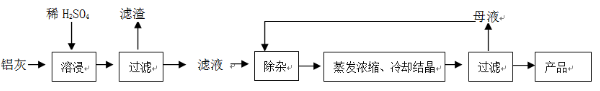
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
科目:高中化学 来源: 题型:填空题
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下: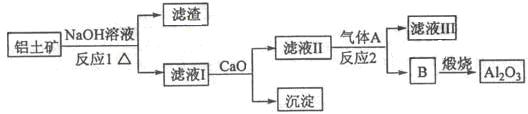
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下: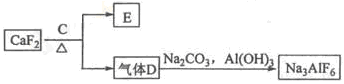
回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)单质铁属于 晶体,将FeCl3溶液加热蒸干、灼烧所得的物质是 (填化学式).
(2)请写出铝与氢氧化钠溶液反应的化学方程式____
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,该深蓝色的浓溶液中加入乙醇所产生的现象是 ,画出呈深蓝色的离子的结构式____ 写出Cu与氨水、双氧水反应的离子方程式:____
(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,写出其化学方程式____
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
元素铝是在生产、生活中应用广泛的金属元素。
(1)从矿石提取氧化铝:矿石与NaOH溶液高温反应,然后降温析出晶体,再经净化和高温煅烧得到氧化铝。降温析出晶体时的反应方程式为: 。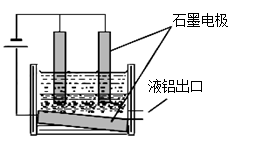
(2)氧化铝是工业电解冶炼铝的重要原料,生产中加入冰晶石(Na3AlF6),其作用是 。
工业冶炼铝的装置示意图如右:
①阴极的反应式 ,
②在电解池工作过程中,需要不断补充阳极材料,原因是 。
(3)有资料介绍:溶液中铝元素以氢氧化物[用Al(OH)3表示]形式存在的pH范围是3.8~10。现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 。
(4)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nCl6-n]m,广泛用于日常生活用水和工业污水的处理。有关PAFC的说法正确的是 。(填选项)
A.PAFC中铁元素显+2价
B.PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
C.PAFC可看作一定比例的氯化铁与氯化铝水解的中间产物
D.PAFC在强酸性和强碱性溶液中都能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
绿矾(FeSO4·7H2O)硫酸法生产一种稀有金属产品过程中产出的副产品,产品外观为淡绿色或淡黄绿色结晶固体。加入适量可调节碱性水中的pH,与水中悬浮物有机结合,并加速沉淀,主要应用于水质净化和工业废水处理,同时具有杀菌作用。
(1)98% 1.84 g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为 (保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为 (填>、<、=")40%" 。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的发烟硫酸,则n=____________(保留两位小数)。
(3)绿矾在空气中容易被部分氧化为硫酸铁,现取7.32克晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32克;再通入112mL(标准状况)氯气恰好将Fe2+完全氧化,推测晶体的化学式为 。
(4)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量。现取8.64克Cu2S和CuS的混合物用200 mL 2 mol/L稀硝酸溶液处理,发生反应如下:
10NO3-+3Cu2S+16H+=6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+=3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好与V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反应。
已知:NO3-+3Fe2++4H+= NO↑+3Fe3++2H2O
① V值范围 ;
② 若V=48,试计算混合物中CuS的质量分数 (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中会分解。
⑴Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
⑵Ⅱ中,需加一定量酸,该酸最好是 。运用化学平衡原理以及离子方程式简述该酸的作用 。
⑶Ⅲ中,生成FeCO3的离子方程式是 。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验SO42-来判断沉淀是否洗涤干净,检验SO42-的操作是
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 =2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)第29届奥运会祥云火炬的外壳材料是高强度的铝镁合金。某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金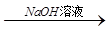 测定生成气体的体积
测定生成气体的体积
方案二:铝镁合金 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金 溶液
溶液 称量灼烧产物的质量。
称量灼烧产物的质量。
(1)写出方案一中发生反应的离子方程式 。
(2)实验小组根据方案二设计了两个实验装置,如下圈(图中的铁架台已省略)。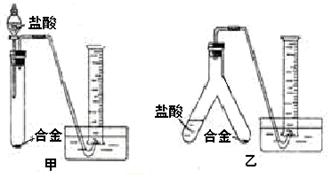
你认为选择 (选填甲或乙)装置进行实验更合理,误差更小。
(3)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的是 。
(4)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示: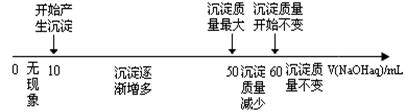
请你判断,根据上图数轴申的数据能否求出合金中镁的质量分数? (选填“能”或“不能”)
下列①②两题选一题作答。
①若不能求出合金中镁的质量分数,请说明理由 。
②若能求出合金中镁的质量分数,则镁的质量分数为 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)。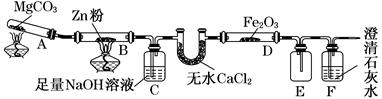
(1)MgCO3的分解产物为________。
(2)装置C的作用是_____________________________________________________,
处理尾气的方法为_______________________________________________________。
(3)将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
(已知:Fe2+与K3[Fe(CN)6]反应产生蓝色沉淀)。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com