
【题目】下列图示与对应的叙述相符的是( )
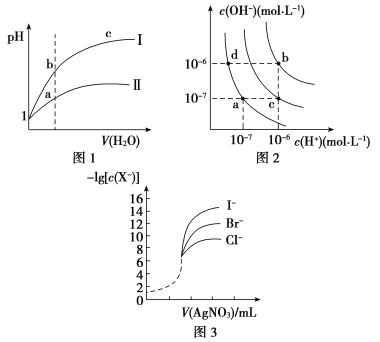
A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2中纯水仅升高温度,就可以从a点变到c点
C.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D.用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
【答案】C
【解析】选C。A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,当开始时二者的pH相同,溶液中c(H+)相等,随着加水稀释,醋酸的电离平衡正向移动,使稀释过程中醋酸溶液中c(H+)大于盐酸,所以稀释相同倍数时盐酸的pH变化较大,醋酸的pH变化较小,溶液中离子浓度越大,溶液的导电性就越强,因此反应图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为醋酸,且a点溶液的导电性比b点强,错误;B.水的电离过程是吸热过程,升高温度,促进水的电离,水电离产生的c(H+)、c(OH-)都增大,若是纯水仅升高温度,就可以从a点变到b点,而若从a点变为c点,则还要加入强酸,不是仅升高温度实现,错误;C.图2中在b点对应温度下,Kw=1.0×10-12;将pH=2的H2SO4,c(H+)=10-2 mol/L与pH=10的NaOH溶液,c(OH-)=10-2 mol/L,二者等体积混合后,则溶液中c酸·V酸=c碱·V碱,n(H+)=n(OH-)所以溶液显中性,正确;D.根据图示可知,AgCl的溶解度最大,AgI的溶解度最小,所以用0. 010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,可确定首先沉淀的是I-,错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是( )

A.图Ⅰ,电流形成的完整过程是:负极Zn-2e-=Zn2+,电子经导线流向正极,正极Cu2++2e-=Cu
B.图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C.图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-=H2↑
D.图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g)△H 有下列两图所示变化:
cC(g)+dD(g)△H 有下列两图所示变化:

试根据上图回答:
(1)压强P1 P2(填﹥、=、﹤,下同)
(2)(a+b) (c+d)
(3)温度t1℃ t2℃
(4)△H 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+B![]() C(g)+D达到平衡时,下列说法不正确的是( )
C(g)+D达到平衡时,下列说法不正确的是( )
A.若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体
B. 升高温度,C的百分含量减小,说明正反应是放热反应
C.增大压强,平衡不移动,说明B、D必是气体
D.若B是气体,增大A的浓度会使B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2+O2![]() 2SO3测得平衡时混合物总的物质的量为5mol,求:
2SO3测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
(3)该条件下的平衡常数K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是( )
A.加入适量的NaCl,可使c(NH![]() )=c(Cl-)
)=c(Cl-)
B.滴加几滴浓氨水,c(NH![]() )减小
)减小
C.滴加几滴浓盐酸,![]() 的值减小
的值减小
D.1.0 mol·L-1的NH4Cl溶液中c(NH![]() )比该混合溶液中的大
)比该混合溶液中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氮原子的质量就是氮的相对原子质量 B. 氢氧化钠的摩尔质量是40g
C. 1molH2SO4中含1molH2 D. 1molH2O的质量是18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】P单质在反应4P+3KOH+3H2O═3KH2PO2+PH3中的变化是( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com