
【题目】(1)某反应过程中的能量变化如下图所示:
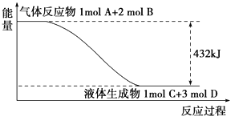
写出该反应的热化学方程式________。
(2)在溶液中进行的化学反应中的物质,其状态标为“aq”,已知1 molHCl在溶液中与足量氢氧化钠反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式:______。
【答案】A(g)+2B(g)=C(l)+3D(l)△H=-432 kJmol-1 H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJmol-1
【解析】
(1)由图可知为放热反应,焓变为负,结合状态及焓变书写热化学方程式;
(2)1molHC1在溶液中与足量氢氧化钠反应放出57.3kJ的热量,可知氢离子与氢氧根离子生成1mol水时放出57.3kJ的热量,据此书写。
(1)从图上可判断反应物总能量高于生成物总能量,反应放热,△H<0,反应物是气态,生成物是液态,则该反应的热化学方程式为A(g)+2B(g)=C(l)+3D(l)△H=-432 kJmol-1;
(2)1 molHCl在溶液中与足量氢氧化钠反应放出57.3 kJ的热量,实质上是1molH+与OH-的中和反应,因此热化学方程式为H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJmol-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.通常状况下,NA个CO2分子占有的体积约为22.4L
B.1mol·L-1Na2SO4溶液中所含Na+的数目为2NA
C.40gNaOH溶解在1L水中,则其100mL溶液中含Na+数为0.1NA
D.14g氮气中含有7NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
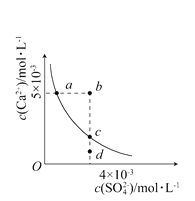
A. 在任何溶液中,c(Ca2+)、c(SO42-)均相等
B. b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol·L-1
C. a点对应的Ksp等于c点对应的Ksp
D. d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、E、R是7种短周期元素。已知X、Y、Z、W在周期表中相对位置如图所示,且W原子最外层电子数是其内层电子数的![]() ,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
![]()
请回答下列问题:
(1)E在周期表中的位置是______;R的单质与镁形成的化合物电子式为____。
(2)由X和Q组成的一种气体,其密度与相同条件下的Y单质密度相同,则该气体使溴水褪色的化学方程式为__________;该反应类型为_______。
(3)关于以上元素说法正确的是_______(填字母)。
a.Y的最简单氢化物分解比Z的难
b.X元素是自然界中能形成化合物种类最多的元素,是因为X在自然界含量最丰富
c.R的单质通常用于自来水的消毒是因为该单质有毒性,可以“以毒攻毒”
d.Z的一种单质可用于制火柴
(4)可利用如图装置(烧瓶B下面的加热装置未画出)验证元素非金属性的强弱关系。
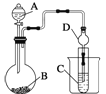
现用药品Na2S溶液、浓盐酸、MnO2来设计实验验证R的非金属性强于W,则:实验中能够说明R的非金属性强于W的主要现象是__________;B中反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
选项 | A | B | C | D |
实验 装置 |
|
|
|
|
实验 目的 | 制取少量纯净的CO2气体 | 验证钠和水的反应是放热反应 | 制取并收集干燥纯净的NH3 | 进行喷泉实验 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
①CaCl2和 Na2S ②Na2O 和 Na2O2 ③CO2和CaO ④HCl 和 NaOH
(2)下列过程不一定释放能量的是________。
①化合反应;②分解反应;③形成化学键;④燃料燃烧;⑤酸碱中和;⑥炸药爆炸
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是________________________________,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。

图1 图2
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石_______(填“稳定”或“不稳定”)。
(5)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______Q2(填大于、小于或等于)。
(6)已知:4HCl+O2=2Cl2+2H2O。该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,且断开O=O键和Cl-Cl键所需的能量如下图所示。则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
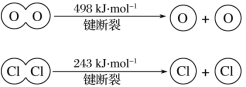
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
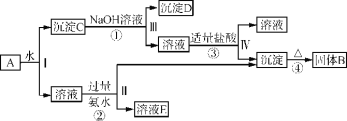
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是____
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B___;沉淀D______;溶液E____。
(3)写出①③反应的化学方程式,离子反应写离子方程式。
①______。
③______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室制备溴苯的一种装置图如图所示:
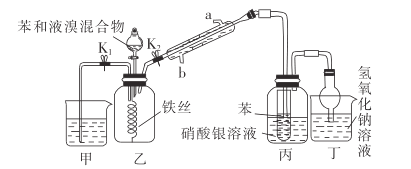
(1)盛装苯和液溴混合物的仪器名称是___________,冷凝水应从_____________(填“a”或“b”)口进入;实验开始时,打开________________(填“![]() ”或“
”或“![]() ”,下同),关闭_________________。
”,下同),关闭_________________。
(2)乙装置中发生反应的化学方程式为________________________________。
(3)丁装置中球形干燥管的作用是_____________________________。
(4)丙装置中的现象是________________________________。
(5)若实验时,实验室无液溴,但有溴水,则如何操作才能继续让该实验做成功?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com