
【题目】X、Y、Z、W、Q、E、R是7种短周期元素。已知X、Y、Z、W在周期表中相对位置如图所示,且W原子最外层电子数是其内层电子数的![]() ,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
![]()
请回答下列问题:
(1)E在周期表中的位置是______;R的单质与镁形成的化合物电子式为____。
(2)由X和Q组成的一种气体,其密度与相同条件下的Y单质密度相同,则该气体使溴水褪色的化学方程式为__________;该反应类型为_______。
(3)关于以上元素说法正确的是_______(填字母)。
a.Y的最简单氢化物分解比Z的难
b.X元素是自然界中能形成化合物种类最多的元素,是因为X在自然界含量最丰富
c.R的单质通常用于自来水的消毒是因为该单质有毒性,可以“以毒攻毒”
d.Z的一种单质可用于制火柴
(4)可利用如图装置(烧瓶B下面的加热装置未画出)验证元素非金属性的强弱关系。
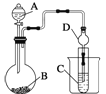
现用药品Na2S溶液、浓盐酸、MnO2来设计实验验证R的非金属性强于W,则:实验中能够说明R的非金属性强于W的主要现象是__________;B中反应离子方程式为________。
【答案】第二周期第VIA族 ![]() CH2=CH2 + Br2 → CH2BrCH2Br 加成反应 ad 装置C中有淡黄色沉淀生成 MnO2+4H++2Cl-
CH2=CH2 + Br2 → CH2BrCH2Br 加成反应 ad 装置C中有淡黄色沉淀生成 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【解析】
X、Y、Z、W、Q、E、R是7种短周期元素。W原子最外层电子数是其内层电子数的![]() ,则其核外电子排布为2、8、6,W为硫(S);由此可确定X为碳(C)、Y为氮(N)、Z为磷(P);Q元素组成的单质是最理想的气体燃料,则Q为氢(H);E的原子最外层电子数是次外层电子数的3倍,则E为氧(O);R的单质通常用于自来水的消毒,则R为氯(Cl)。
,则其核外电子排布为2、8、6,W为硫(S);由此可确定X为碳(C)、Y为氮(N)、Z为磷(P);Q元素组成的单质是最理想的气体燃料,则Q为氢(H);E的原子最外层电子数是次外层电子数的3倍,则E为氧(O);R的单质通常用于自来水的消毒,则R为氯(Cl)。
由以上分析可知,X、Y、Z、W、Q、E、R分别为C、N、P、S、H、O、Cl。
(1)E为氧,核外电子排布为2、6,则其在周期表中的位置是第二周期第VIA族;R为氯(Cl),它的单质与镁形成MgCl2,电子式为![]() 。答案为:第二周期第VIA族;
。答案为:第二周期第VIA族;![]() ;
;
(2)由C和H组成的一种气体,其密度与相同条件下的N2密度相同,则相对分子质量为28,其为乙烯,乙烯使溴水褪色的化学方程式为CH2=CH2 + Br2 → CH2BrCH2Br;该反应为加成反应。答案为:CH2=CH2 + Br2 → CH2BrCH2Br;加成反应;
(3)a.因为非金属性N>P,所以氢化物的稳定性NH3>PH3,a正确;
b.碳元素形成化合物种类最多,是因为碳呈四价且碳原子间能形成单键、双键、三键等,b不正确;
c.氯的单质通常用于自来水的消毒,是因为其与水反应生成HClO,具有杀菌消毒能力,c不正确;
d.磷的一种单质红磷可用于制安全火柴,d正确;
故选ad。答案为:ad;
(4)从图中可知,B中放入MnO2,与A中的浓盐酸在加热条件下反应生成Cl2,Cl2与Na2S发生置换反应生成S和NaCl,则实验中能够说明Cl的非金属性强于S的主要现象是装置C中有淡黄色沉淀生成;B中反应离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。答案为:装置C中有淡黄色沉淀生成;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。答案为:装置C中有淡黄色沉淀生成;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4![]() FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
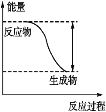
(1)该反应为____(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸
C.升高温度 D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____(填“正”或“负”)极。铜片上产生的现象为_________,该极上发生的电极反应为_______________,外电路中电子由____(填“正”或“负”,下同)极向____极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,基态原子电子排布式为____。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有__。
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为___。(用NA表示阿伏伽德罗常数的值)
(4)与N3-互为等电子体的分子有___(写其中一个的化学式即可)。
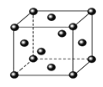
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为___,列式表示Ce(铈)单质的密度:___g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物G可用于生产降解塑料,合成G的有关转化关系如下
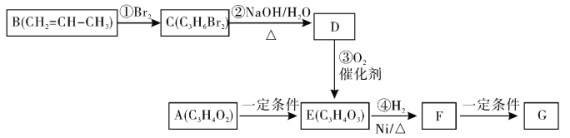
已知:物质A能够发生银镜反应,请回答下列问题:
(1)写出物质D的结构简式___________,C的名称为___________。
(2)F的官能团名称为___________。A→E的反应类型为:___________。
(3)下列说法正确的是___________(填字母序号)。
A.1molE与足量的H2在一定条件下发生反应,最多消耗2molH2
B. 1mol F与足量NaOH溶液反应,最多消耗1 molNaOH
C.物质B存在顺反异构体
D.D能使酸性高锰酸钾溶液褪色
(4)写出物质A发生银镜反应的化学方程式:_________________________________。
(5)写出F→G的化学方程式:_________________________________。
(6)化合物F有多种同分异构体,写出符合下列条件F的二种同分异构体的结构简式:____、_____。
①能与NaOH溶液反应;②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是
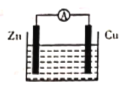
A. 锌做负极发生氧化反应
B. 供电时的总反应为Zn+2H+=Zn2++H2↑
C. 该装置可实现化学能转化为电能
D. 正极产生1 mol H2,消耗锌的质量为32.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式,不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融) ![]() Mg + Cl2↑[
Mg + Cl2↑[
B.向Ca(ClO)2溶液中通入少量CO2:Ca2+ + 2ClO-+H2O+CO2 == 2HClO +CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) == CaCO3(s) + Na2SO4(aq)
D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某反应过程中的能量变化如下图所示:
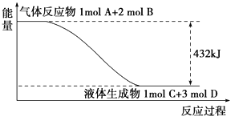
写出该反应的热化学方程式________。
(2)在溶液中进行的化学反应中的物质,其状态标为“aq”,已知1 molHCl在溶液中与足量氢氧化钠反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
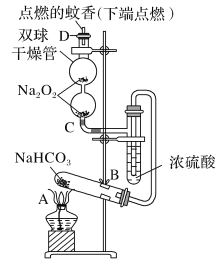
(1)在A试管内发生反应的化学方程式是_____。
(2)B装置的作用是_____。
(3)在双球干燥管内发生反应的化学方程式为____。
(4)双球干燥管内及D处观察到的实验现象是_____。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内及D处观察到的实验现象是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
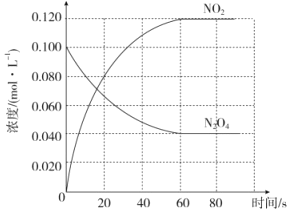
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,10s又达到平衡。T_______100℃(填“大于”“小于”)。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动
(4)再次到达平衡后,向容器中加入合适的正催化剂,则v正_______v逆_______,(填“增大”、“减小”或“不变”),体系的颜色_______(填“变深” “变浅”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com