
【题目】高聚物G可用于生产降解塑料,合成G的有关转化关系如下
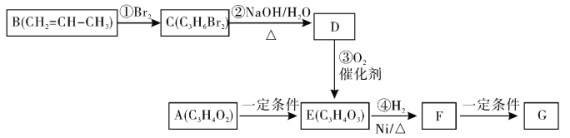
已知:物质A能够发生银镜反应,请回答下列问题:
(1)写出物质D的结构简式___________,C的名称为___________。
(2)F的官能团名称为___________。A→E的反应类型为:___________。
(3)下列说法正确的是___________(填字母序号)。
A.1molE与足量的H2在一定条件下发生反应,最多消耗2molH2
B. 1mol F与足量NaOH溶液反应,最多消耗1 molNaOH
C.物质B存在顺反异构体
D.D能使酸性高锰酸钾溶液褪色
(4)写出物质A发生银镜反应的化学方程式:_________________________________。
(5)写出F→G的化学方程式:_________________________________。
(6)化合物F有多种同分异构体,写出符合下列条件F的二种同分异构体的结构简式:____、_____。
①能与NaOH溶液反应;②能发生银镜反应
【答案】![]() 1,2-二溴丙烷 羟基、羧基 氧化反应 BD CH3COCHO+2Ag(NH3)2OH
1,2-二溴丙烷 羟基、羧基 氧化反应 BD CH3COCHO+2Ag(NH3)2OH![]() CH3 COCOONH4+2Ag↓+3NH3+H2O
CH3 COCOONH4+2Ag↓+3NH3+H2O  HCOOCH2CH2OH HCOOCH(OH)CH3、HCOOCH2OCH3(写出其中的2种)
HCOOCH2CH2OH HCOOCH(OH)CH3、HCOOCH2OCH3(写出其中的2种)
【解析】
B为CH3-CH=CH2,B与溴加成生成C为CH3CHBrCH2Br,C在碱性条件下水解得到D为CH3CHOHCH2OH,D氧化得E为CH3COCOOH,A能够发生银镜反应,说明含有醛基,被氧化生成羧基,则推知A为CH3COCHO;E与氢气发生加成反应得F为CH3CHOHCOOH,F在一定条件下发生缩聚反应得G,以此分析解答。
B为CH3-CH=CH2,B与溴加成生成C为CH3CHBrCH2Br,C在碱性条件下水解得到D为CH3CHOHCH2OH,D氧化得E为CH3COCOOH,A能够发生银镜反应,说明含有醛基,被氧化生成羧基,则推知A为CH3COCHO;E与氢气发生加成反应得F为CH3CHOHCOOH,F在一定条件下发生缩聚反应得G,
(1)根据上面的分析可以知道,物质D的结构简式为![]() ,C的名称为1,2-二溴丙烷,
,C的名称为1,2-二溴丙烷,
因此,本题正确答案是:![]() ;1,2-二溴丙烷;
;1,2-二溴丙烷;
(2)F为CH3CHOHCOOH,则F中的含氧官能团为羟基、羧基;A→E的反应为醛基被氧化为羧基,反应类型为:氧化反应;
因此,本题正确答案是:羟基、羧基;氧化反应;
(3)A. E为CH3COCOOH,1molE与足量的H2在一定条件下发生反应,最多消耗1molH2,故A错误;
B. F为CH3CHOHCOOH,1mol F与足量NaOH溶液反应,最多消耗1 molNaOH,故B正确;
C. B为CH3-CH=CH2,由结构可知物质B不存在顺反异构体,故C错误;
D. D为CH3CHOHCH2OH,含有醇羟基,能使酸性高锰酸钾溶液褪色,故D正确。
因此,本题正确答案是:BD;
(4) A为CH3COCHO,含有醛基,其发生银镜反应的化学方程式:CH3COCHO+2Ag(NH3)2OH![]() CH3 COCOONH4+2Ag↓+3NH3+H2O;
CH3 COCOONH4+2Ag↓+3NH3+H2O;
因此,本题正确答案是:CH3COCHO+2Ag(NH3)2OH![]() CH3 COCOONH4+2Ag↓+3NH3+H2O;
CH3 COCOONH4+2Ag↓+3NH3+H2O;
(5)F在一定条件下发生缩聚反应得G,反应方程式为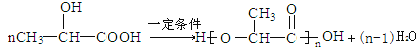 ;
;
因此,本题正确答案是: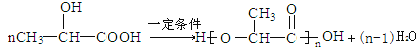 ;
;
(6) F为CH3CHOHCOOH,F的同分异构体中①能与NaOH溶液反应说明含有羧基或酯基;②能发生银镜反应说明含有醛基,综合①②可知应含有HCOO-的结构,所以可能的结构简式为:HCOOCH2CH2OH、HCOOCH(OH)CH3、HCOOCH2OCH3(写出其中的2种),
因此,本题正确答案是:HCOOCH2CH2OH、HCOOCH(OH)CH3、HCOOCH2OCH3(写出其中的2种)。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
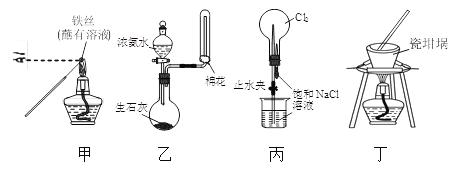
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉加热反应的化学方程式为:________________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):_______→________→________→________。
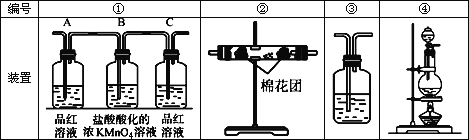
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是:___________________________________,
B瓶溶液的作用是_____________________________________,
C瓶溶液的作用是_____________________________________。
(4)装置②中所加的白色固体药品是_____________,可验证的产物是____________。
(5)装置③中所盛的溶液是__________________,可验证的产物是_____________。
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是_______________填化学式,下同),不能检出的产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见下图。下列说法正确的是 ( )
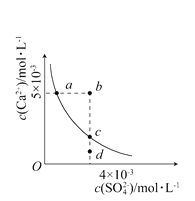
A. 在任何溶液中,c(Ca2+)、c(SO42-)均相等
B. b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol·L-1
C. a点对应的Ksp等于c点对应的Ksp
D. d点溶液通过蒸发可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
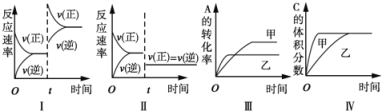
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、E、R是7种短周期元素。已知X、Y、Z、W在周期表中相对位置如图所示,且W原子最外层电子数是其内层电子数的![]() ,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
,Q元素组成的单质是最理想的气体燃料,E的原子最外层电子数是次外层电子数的3倍,R的单质通常用于自来水的消毒。
![]()
请回答下列问题:
(1)E在周期表中的位置是______;R的单质与镁形成的化合物电子式为____。
(2)由X和Q组成的一种气体,其密度与相同条件下的Y单质密度相同,则该气体使溴水褪色的化学方程式为__________;该反应类型为_______。
(3)关于以上元素说法正确的是_______(填字母)。
a.Y的最简单氢化物分解比Z的难
b.X元素是自然界中能形成化合物种类最多的元素,是因为X在自然界含量最丰富
c.R的单质通常用于自来水的消毒是因为该单质有毒性,可以“以毒攻毒”
d.Z的一种单质可用于制火柴
(4)可利用如图装置(烧瓶B下面的加热装置未画出)验证元素非金属性的强弱关系。
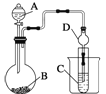
现用药品Na2S溶液、浓盐酸、MnO2来设计实验验证R的非金属性强于W,则:实验中能够说明R的非金属性强于W的主要现象是__________;B中反应离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
①CaCl2和 Na2S ②Na2O 和 Na2O2 ③CO2和CaO ④HCl 和 NaOH
(2)下列过程不一定释放能量的是________。
①化合反应;②分解反应;③形成化学键;④燃料燃烧;⑤酸碱中和;⑥炸药爆炸
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是________________________________,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。

图1 图2
(4)已知1 mol石墨转化为1 mol金刚石要吸收能量,则石墨比金刚石_______(填“稳定”或“不稳定”)。
(5)一定量的氢气在氧气中充分燃烧并放出热量。若生成气态水放出的热量为Q1,生成液态水放出的热量为Q2,那么Q1______Q2(填大于、小于或等于)。
(6)已知:4HCl+O2=2Cl2+2H2O。该反应中,4 mol HCl被氧化,放出115.6 kJ的热量,且断开O=O键和Cl-Cl键所需的能量如下图所示。则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为______ kJ。
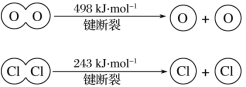
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___。
(2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___。
(3)C、H、O三种元素的电负性由小到大的顺序为____。
(4)乙醇的沸点高于丙酮,这是因为______。
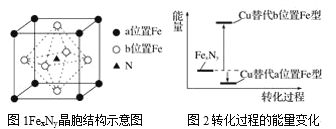
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为____。
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量1溴丙烷的主要步骤如下:步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20 mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
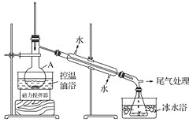
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。
(1)仪器A的名称是___;加入搅拌磁子的目的是搅拌和___。
(2)反应时生成的主要有机副产物有2溴丙烷和____。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_____。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是___。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL5%Na2CO3溶液,振荡,___,静置,分液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com