
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
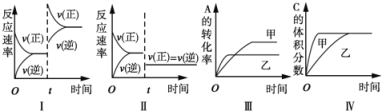
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸氢钠与少量氢氧化钡反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C.钠与水反应:Na+2H2O=Na++2OH-+H2↑
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小时候很想知道天天喝的水究竟由啥构成?到了初中又想查查这瓶纯净水(蒸馏水,体积360mL,密度1g/cm3)中有多少个水分子呢?学了“物质的量”这个能在宏观物质和微观粒子之间架起“桥梁”的物理量,实现这个愿望太简单了。请填空:
这瓶纯净水的质量为______ g,含有水分子______个,含有原子总数_____NA个(NA表示阿伏伽德罗常数),若把这些水变成水蒸气再换算到标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物G可用于生产降解塑料,合成G的有关转化关系如下
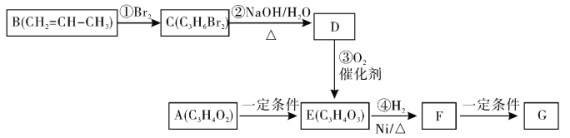
已知:物质A能够发生银镜反应,请回答下列问题:
(1)写出物质D的结构简式___________,C的名称为___________。
(2)F的官能团名称为___________。A→E的反应类型为:___________。
(3)下列说法正确的是___________(填字母序号)。
A.1molE与足量的H2在一定条件下发生反应,最多消耗2molH2
B. 1mol F与足量NaOH溶液反应,最多消耗1 molNaOH
C.物质B存在顺反异构体
D.D能使酸性高锰酸钾溶液褪色
(4)写出物质A发生银镜反应的化学方程式:_________________________________。
(5)写出F→G的化学方程式:_________________________________。
(6)化合物F有多种同分异构体,写出符合下列条件F的二种同分异构体的结构简式:____、_____。
①能与NaOH溶液反应;②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。请回答下列问题:
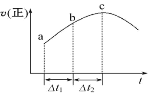
①a~c段反应速率增大的原因是____________。
②有关该反应的说法正确的是________(填字母)。
a.若容器内温度保持不变,可以说明反应达到了平衡状态
b.反应物浓度:a点小于b点
c.反应在c点达到平衡状态
d.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
e.若容器内气体的平均摩尔质量保持不变,可以说明反应达到了平衡状态
(2)利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示。此装置既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。请回答下列问题:
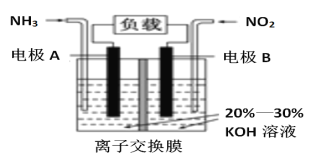
①B电极为______(填“正”或“负”)。
②当有4.48 L NH3(标准状况)参加反应时,转移电子数为________。
③电极A极反应式为______。
④为使电池持续放电,离子交换膜最好选用__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式,不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融) ![]() Mg + Cl2↑[
Mg + Cl2↑[
B.向Ca(ClO)2溶液中通入少量CO2:Ca2+ + 2ClO-+H2O+CO2 == 2HClO +CaCO3↓
C.用CaSO4治理盐碱地:CaSO4(s) + Na2CO3(aq) == CaCO3(s) + Na2SO4(aq)
D.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72- + Fe2+ + 14H+ == 2Cr3+ + Fe3+ + 7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将久置在空气中的锌粒投人稀硫酸中,测得锌粒和硫酸反应产生氢气的速率v(H2)与反应时间t的关系曲线如图所示。下列推论不正确的是( )

A.O→a段由于是锌粒表面的氧化物与酸的反应,所以未产生气体
B.b→c段产生氢气的速率增大较快的主要原因是温度升高
C.c时刻反应生成的H2的量最多
D.c时刻之后产生氢气的速率减小的主要原因是溶液中c(H+ )减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.碳酸钠溶液中逐滴加入等物质的量的乙酸 CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.二氧化硫通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO
C.用碳棒作电极电解氯化钠饱和溶液 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.碳酸钡溶于氢氟酸 BaCO3+2H+=Ba2++H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com