
【题目】下列离子方程式书写正确的是( )
A.硫酸氢钠与少量氢氧化钡反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C.钠与水反应:Na+2H2O=Na++2OH-+H2↑
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法正确的是
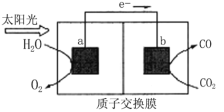
A.该装置工作时,H+从b极区向a极区移动
B.电极a表面发生还原反应
C.该过程至少涉及到3种能量的转化
D.该装置中每生成1molCO,同时生成1molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.H2SO4的摩尔质量以g·mol-1为单位时,与NA个硫酸分子的质量以g为单位时在数值上相等
B.NA个氧气分子和NA个氮气分子的质量比为8∶7
C.常温常压下,2.86gNa2CO3·10H2O含有的Na+个数为0.02NA
D.物质的量浓度为0.5mol/L的CaCl2溶液中,含有的Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 增加固体反应物的质量,反应速率一定加快
B. 镁与稀盐酸反应时,加入适量的氯化钾溶液,生成氢气的速率不变
C. 对于可逆反应,升高反应体系温度,正反应速率和逆反应速率均增加
D. A(g)+B(g)![]() C(g)+D(g),恒温恒容充入 He 以增大压强,化学反应速率加快
C(g)+D(g),恒温恒容充入 He 以增大压强,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)
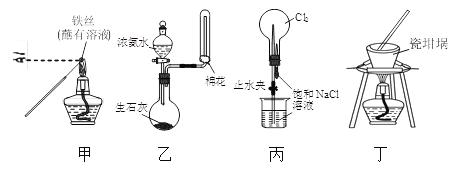
A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0 kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO(g)还原Fe2O3(s)的热化学方程式为____。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_____。
(3)将CO2和H2充入1L的密闭容器中,在两种温度下发生反应:
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①该反应的平衡常数表达式为K=___。
②曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___KⅡ(填“>”或“=”或“<”)。
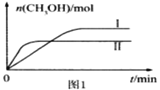
③一定温度下,往该容器中投入1 molCO2、3 mol H2 ,一段时间后达到平衡。若平衡后气体的压强为开始的0.8倍,则CO2的平衡转化率=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉加热反应的化学方程式为:________________。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号):_______→________→________→________。
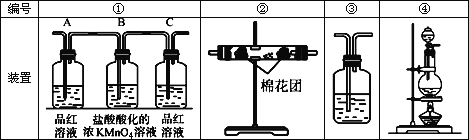
(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是:___________________________________,
B瓶溶液的作用是_____________________________________,
C瓶溶液的作用是_____________________________________。
(4)装置②中所加的白色固体药品是_____________,可验证的产物是____________。
(5)装置③中所盛的溶液是__________________,可验证的产物是_____________。
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是_______________填化学式,下同),不能检出的产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
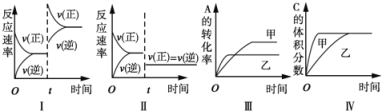
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) ![]() 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)![]() N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com