
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
【答案】 ![]() 加热(或煅烧) 电解法 a c 2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH=85.6kJ·mol1 在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液 CrO42-和Cr2O72- NaOH和H2
加热(或煅烧) 电解法 a c 2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH=85.6kJ·mol1 在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液 CrO42-和Cr2O72- NaOH和H2
【解析】惰性电极电解混合物浆液时,Na+移向阴极,CrO42-移向阳极。Al(OH)3、MnO2剩下在固体混合物中。固体混合物加入NaOH时,Al(OH)3转化为AlO2-,通入CO2转化为Al(OH)3沉淀,再加热分解为Al2O3,最后熔融电解得Al。
(1)NaOH的电子式为![]() ;根据上述分析,B→C的条件为加热或煅烧,C→Al的制备方法称为电解法。
;根据上述分析,B→C的条件为加热或煅烧,C→Al的制备方法称为电解法。
(2)根据实验方案可知,D与浓盐酸混合,不加热,无变化;加热有Cl2生成,可知温度对该反应有影响;当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。说明加入H+能继续产生Cl2,可知溶液的酸度对该反应有影响,综上所述,影响该反应的因素有温度和溶液的酸度,故选ac。
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,配平方程式,可知2mol Cl2反应放热85.6kJ·mol1,由此可得该反应的热化学方程式为2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH=85.6kJ·mol1。
(4)用惰性电极电解时,在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液,从而使CrO42-从浆液中分离出来;因2CrO42-+2H+![]() Cr2O72-+H2O,所以分离后含铬元素的粒子是CrO42-和Cr2O72-;阴极室H+放电生成H2,剩余的OH-与透过阳离子交换膜移过来的Na+结合生成NaOH,所以阴极室生成的物质为NaOH和H2。
Cr2O72-+H2O,所以分离后含铬元素的粒子是CrO42-和Cr2O72-;阴极室H+放电生成H2,剩余的OH-与透过阳离子交换膜移过来的Na+结合生成NaOH,所以阴极室生成的物质为NaOH和H2。


科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置模拟侯氏制碱法的主要反应原理。下列说法正确的是( )

A.侯氏制碱法中可循环利用的气体为NH3
B.反应后冷却,瓶中析出的晶体主要是纯碱
C.为吸收剩余的NH3,c中应装入碱石灰
D.先从a管通入NH3,再从b管通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度为1 mol/L的五种溶液:①HCI,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A. ②>①>③>④>⑤ B. ①=②>③>④>⑤
C. ④>③>①=⑤>② D. ④>③>①>⑤>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的联接并填空:

(1)在A图中,使铜片上冒H2气泡。请加以必要的
联接,则联接后的装置叫____________。电极反应式:
锌板:_____________________;铜板:_______________________。
(2)在B图中,若a,b为惰性电极,使a极析出铜,则b析出:_________________。
加以必要的联接后,该装置叫________________。电极反应式,a极:______________________ b极:______________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值__________(升高、降低、不变),加入一定量的_________后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )

A.2F2+2H2O═4HF+O2
B.AgNO3+NaCl═AgCl↓+NaNO3
C.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
D.MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(每空1分)Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
(1)下列有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,写出苯与溴发生反应的化学方程式 ___________________________________,
预测该芳香烃____________ (填“能”或“不能”)发生该类反应。
A.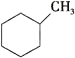 B.
B. C.
C.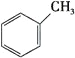
(2)下列有机物属于羧酸类的是_________ (填字母)。
a.CH3CHO b.![]() c.
c. 
(3)下列有机物属于糖类的是_________ (填字母)。
A.油脂 B.纤维素 C.蛋白质
Ⅱ.下列几组物质中,互为同位素的有____________,互为同素异形体的有___________,互为同系物的有____________,互为同分异构体的有____________,属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]() ④
④ 和
和
⑤CH3(CH2)2CH3和(CH3)2CHCH3 ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有HA、HB和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。

(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1,Ka(HB)=________。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
(4)已知温度时,0.1 mol·L-1的某一元酸HB在水中有 0.1% 发生电离,回答下列各问题:
①该溶液的pH=________。
②HB的电离平衡常数K=________。
③由HB电离出的c(H+)约为水电离出的c(H+)的________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是

A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com