
【题目】现有浓度为1 mol/L的五种溶液:①HCI,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A. ②>①>③>④>⑤ B. ①=②>③>④>⑤
C. ④>③>①=⑤>② D. ④>③>①>⑤>②
【答案】C
【解析】
水能发生微弱的电离:H2O![]() H++OH-。五种物质中只有NH4Cl能发生水解反应,促进水的电离,其它物质都是抑制水的电离,所以等浓度时NH4Cl溶液中由水电离出来的H+浓度最大;等浓度下H2SO4电离的H+浓度最大,它对水的抑制作用最强,所以H2SO4溶液中由水电离出来的H+浓度最小;等浓度时HCl电离产生的H+浓度与NaOH电离产生的OH-浓度相等,所以等浓度时HCl与NaOH对水电离的抑制作用相同,即HCl与NaOH溶液中由水电离产生的H+浓度相等;CH3COOH是弱酸,等浓度时电离产生的H+浓度比HCl小,对水电离的抑制作用比HCl弱,所以等浓度时CH3COOH溶液中由水电离产生的H+浓度比HCl多,总之,五种溶液中由水电离产生的c(H+)大小关系是:④>③>①=⑤>②。答案选C。
H++OH-。五种物质中只有NH4Cl能发生水解反应,促进水的电离,其它物质都是抑制水的电离,所以等浓度时NH4Cl溶液中由水电离出来的H+浓度最大;等浓度下H2SO4电离的H+浓度最大,它对水的抑制作用最强,所以H2SO4溶液中由水电离出来的H+浓度最小;等浓度时HCl电离产生的H+浓度与NaOH电离产生的OH-浓度相等,所以等浓度时HCl与NaOH对水电离的抑制作用相同,即HCl与NaOH溶液中由水电离产生的H+浓度相等;CH3COOH是弱酸,等浓度时电离产生的H+浓度比HCl小,对水电离的抑制作用比HCl弱,所以等浓度时CH3COOH溶液中由水电离产生的H+浓度比HCl多,总之,五种溶液中由水电离产生的c(H+)大小关系是:④>③>①=⑤>②。答案选C。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
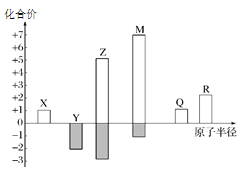
A.Q位于第三周期ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.Z与M的最高价氧化物对应水化物均为强酸
D.简单离子半径:M->Q+>R2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl溶液中,下列叙述错误的是( )
A. c(NH4+) + c( H+ ) = c(Cl—) + c(OH— ) B. c(Cl—)>c(NH4+)>c( H+ )>c(OH— )
C. c(NH4+)>c(Cl—) >c(OH— ) >c( H+ ) D. c(NH4+) + c( NH3 · H2O ) = c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第1~4周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是____(填元素符号,下同),第一电离能最小的是____;
(2)C所在的主族元素气态氢化物中,沸点最低的是____(填化学式);
(3)B元素可形成多种单质,其中”只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为______;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是____(填选项序号);

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质![]() 棕色的烟
棕色的烟![]() 绿色溶液
绿色溶液![]() 蓝色沉淀
蓝色沉淀![]() 蓝色溶液
蓝色溶液![]() 黑色沉淀
黑色沉淀
请书写第⑤步反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:

(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________________________。
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择________作正极材料,________作负极材料;选择________作电解质溶液。
(2)写出有关的电极反应式:正极:__________________;负极:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为_______ ,(写出元素符号,下同),电子排布式是________________________;
B为_______,简化电子排布式是________________________;
C为_______,价电子排布式是________________________;
D为_______,电子排布图是________________________;
E为_______,原子结构示意图是________________________;
(2)A、B、C、D四种元素电负性由大到小的顺序为________________________;
(3)A、B、C、D四种元素第一电离能由小到大的顺序为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A. 将40gNaOH固体溶于1L水中
B. 将22.4 L氯化氢气体溶于水配成1L溶液
C. 将1L 10mol/L的浓盐酸与9L水混合
D. 将10g NaOH固体溶解在水中配成250 mL溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com