
【题目】用如图所示的实验装置模拟侯氏制碱法的主要反应原理。下列说法正确的是( )

A.侯氏制碱法中可循环利用的气体为NH3
B.反应后冷却,瓶中析出的晶体主要是纯碱
C.为吸收剩余的NH3,c中应装入碱石灰
D.先从a管通入NH3,再从b管通入CO2
【答案】D
【解析】
侯氏制碱法又叫联合制碱法,操作过程为:
首先,将足量NH3通入饱和食盐水中,NH3会溶解到溶液中,再通入CO2,溶液中会生成高浓度的HCO3-:NH3+H2O+CO2=NH4HCO3;HCO3-与原有的高浓度Na+结合成溶解度较小的NaHCO3析出:NH4HCO3+NaCl=NH4Cl+NaHCO3↓,总反应可表示为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
然后,将析出的沉淀加热,制得Na2CO3 (纯碱):2NaHCO3![]() Na2CO3+ H2O +CO2 ↑,生成的CO2可用于上一步反应(循环利用);
Na2CO3+ H2O +CO2 ↑,生成的CO2可用于上一步反应(循环利用);
A.根据分析,侯氏制碱法中可循环利用的气体是CO2 , A错误;
B.反应后冷却,瓶中析出的晶体主要是NaHCO3(小苏打),将其加热才能得到纯碱( Na2CO3),B错误;
C.碱石灰(主要成分是NaOH和CaO )不能吸收NH3 , C错误;
D.先通入NH3,NH3极易溶于水,为了防止倒吸,应从a管通入,之后再从b管通入CO2,D项正确;
故选D。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】硫黄在空气中燃烧生成气体甲,甲溶于水得溶液乙,向乙溶液中滴加溴水,溴水褪色,乙变成丙。在丙里加入Na2S生成气体丁,把丁通入乙得到沉淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们正确的顺序是
A. SO3、H2SO4、H2SO3、H2S、SB. SO2、H2SO3、H2SO4、SO2、SO3
C. SO3 、H2SO4、H2SO3、SO2、Na2S2O3D. SO2、H2SO3、H2SO4、H2S、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某放热反应能自发进行,则该反应一定是熵增的反应
B. 0.1 mol·L-1 CH3COONa溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. pH相等的①(NH4)2SO4 ②NH4HSO4 ③NH4Cl三种溶液中,c(NH4+)大小:①>③>②
D. 某温度时水的离子积常数KW=10-12,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9∶11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有4 mol HCl和1 mol MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生的沉淀质量m与加入Ba(OH)2物质的量n之间的关系如右图,下列说法正确的是( )

A. a→b时的沉淀的成分为BaSO4与Mg(OH)2
B. b→c时发生的离子反应为:H++ OH—→ H2O
C. c→d时离子的物质的量:Ba2+可能大于Cl—
D. d→e时离子的物质的量:Ba2+一定大于OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是( )
A. NH4Cl的电子式:![]() B. S2–的结构示意图:
B. S2–的结构示意图: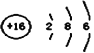
C. CO2的结构式:O=C=OD. 中子数为20的氯原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
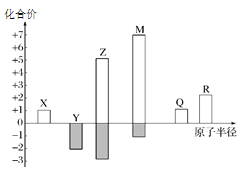
A.Q位于第三周期ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.Z与M的最高价氧化物对应水化物均为强酸
D.简单离子半径:M->Q+>R2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl溶液中,下列叙述错误的是( )
A. c(NH4+) + c( H+ ) = c(Cl—) + c(OH— ) B. c(Cl—)>c(NH4+)>c( H+ )>c(OH— )
C. c(NH4+)>c(Cl—) >c(OH— ) >c( H+ ) D. c(NH4+) + c( NH3 · H2O ) = c(Cl—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com