
【题目】下列说法正确的是
A. 某放热反应能自发进行,则该反应一定是熵增的反应
B. 0.1 mol·L-1 CH3COONa溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. pH相等的①(NH4)2SO4 ②NH4HSO4 ③NH4Cl三种溶液中,c(NH4+)大小:①>③>②
D. 某温度时水的离子积常数KW=10-12,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9∶11
【答案】D
【解析】
A.只要满足△H-T△S<0反应就可自发进行,不一定是熵增的反应,故A错误;
B. 因混合后溶液中含等量的NaCl、CH3COOH及CH3COONa,酸与盐的混合溶液显酸性,考虑醋酸的电离平衡,忽略醋酸钠水解平衡,所以应该是c(CH3COO-)> c(Cl-)> c(CH3COOH)>c(H+),故B错误;
C. 三个溶液都是酸性的,阴离子都不会水解,如果只考虑NH4+水解导致溶液的PH降低,效果都是一样的,所以NH4+的浓度应该相等,但是NH4HSO4会电离出H+导致溶液酸性增强,所以同PH下,不用那么多的NH4+水解了,所以NH4HSO4中的NH4+浓度最小,NH4Cl ,(NH4)2SO4中铵根离子浓度相等,所以c(NH4+)大小:①=③>②,故C错误;
D.某温度时水的离子积常数KW=10-12,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则10-2=![]() ,得a∶b=9∶11,故D正确;
,得a∶b=9∶11,故D正确;
正确答案:D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否。下列类推结论中正确的是( )
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS
D.CO2通入到硝酸钡溶液中不能生成沉淀;SO2通入到硝酸钡溶液中也不能生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2的一些性质或用途如图,下列说法正确的是( )

A. ①、②、③三个反应中MnO2均作氧化剂
B. 足量MnO2与2 L 10 mol/L HCl共热,可生成5 mol Cl2
C. 反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子
D. 反应③中K2CO3和KNO3的化学计量数均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② 2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
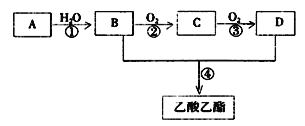
回答下列问题:
(1)B、D分子中的官能团名称分别是____、_____。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①__________;
②__________;
④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是
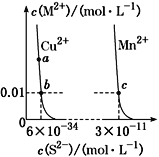
A. 在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=1∶2×10-23
B. 向CuSO4溶液中加入MnS发生反应:
Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)
CuS(s)+Mn2+(aq)
C. a点对应的Ksp等于b点对应的Ksp
D. 该温度下,Ksp(CuS)小于Ksp(MnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置模拟侯氏制碱法的主要反应原理。下列说法正确的是( )

A.侯氏制碱法中可循环利用的气体为NH3
B.反应后冷却,瓶中析出的晶体主要是纯碱
C.为吸收剩余的NH3,c中应装入碱石灰
D.先从a管通入NH3,再从b管通入CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01 mol的酸性混合溶液中加入0.01 mol铁粉,经搅拌后发生的变化应是 ( )
A. 铁溶解,析出0.01 mol Ag和0.005 mol Cu
B. 铁溶解,析出0.01 mol Ag并放出H2
C. 铁溶解,析出0.01 mol Ag,溶液中不再有Fe3+
D. 铁溶解,析出0.01 mol Ag,溶液中不再有Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对下图中两极进行必要的联接并填空:

(1)在A图中,使铜片上冒H2气泡。请加以必要的
联接,则联接后的装置叫____________。电极反应式:
锌板:_____________________;铜板:_______________________。
(2)在B图中,若a,b为惰性电极,使a极析出铜,则b析出:_________________。
加以必要的联接后,该装置叫________________。电极反应式,a极:______________________ b极:______________________。经过一段时间后,停止反应并搅均溶液,溶液的pH值__________(升高、降低、不变),加入一定量的_________后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com