


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
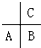 短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )
短周期元素A、B、C(均不为稀有气体元素)在周期表中的位置如图:下列说法正确的是( )| A、若均为非金属元素,其气态氢化物稳定性:A<B<C |
| B、若均为金属元素,其最高价氧化物的水化物的碱性:A<B<C |
| C、原子半径:A>C>B |
| D、最高正价:A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑥ |
| B、②⑤④①③⑥ |
| C、①②④⑤③⑥ |
| D、④②③①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热化学方程式中,各物质前的化学计量数不表示分子个数 |
| B、如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 |
| C、在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热 |
| D、在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com