

| V 2-V 1 |
| 22.4 |
| 0.0025(V2-V1) |
| m |
| V 2-V 1 |
| 400m |
| V 2-V 1 |
| 400m |


科目:高中化学 来源: 题型:
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Na+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、容器内B、C、D的浓度之比为2:1:1 |
| D、混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
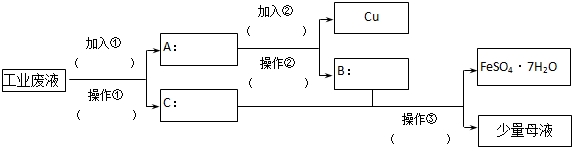
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子中碳、氢原子个数比为1:2,证明乙烯分子里含有一个碳碳双键 |
B、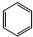 表示苯分子的结构,因此能解释邻二甲苯有 表示苯分子的结构,因此能解释邻二甲苯有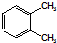 和 和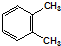 两种结构 两种结构 |
C、因为甲烷是一种正四面体结构,所以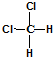 和 和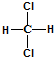 属于同一种物质 属于同一种物质 |
| D、苯的分子式是C6H6,分子式中碳原子远没有饱和,因此苯能使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com