
| 2×9+2-8 |
| 2 |
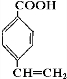 ,据此解答.
,据此解答.| 2×9+2-8 |
| 2 |
 ,故答案为:
,故答案为: ;
;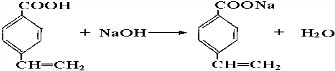 ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度/ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
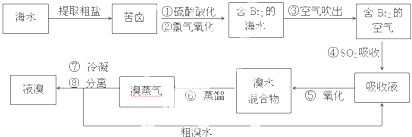
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入少量NaOH,平衡逆向移动,新平衡时c(OH-)降低 |
| B、向水中加入少量NH4Cl,平衡正向移动,新平衡时c(OH-)降低 |
| C、pH=5的醋酸和pH=9的氨水中由水电离出的c(OH-)不相等 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol-1,则氢气的标准燃烧热为-241.8 kJ?mol-1 |
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C、含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.65 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1 |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用硫酸铜溶液测试 |
| B、用氢氧化钠溶液测试 |
| C、用新制的氢氧化铜悬浊液 |
| D、用PH试纸测试 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com