
| A、9:1 | B、1:9 |
| C、1:10 | D、10:1 |


科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、容器内B、C、D的浓度之比为2:1:1 |
| D、混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸钠固体 |
| B、醋酸钠固体 |
| C、硫酸铜溶液 |
| D、硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH中的H+数目 |
| B、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH的电离常数 |
| C、在4NH3+6NO═5N2+6H2O反应中,被氧化和被还原的N原子数 |
| D、纯水在25℃和80℃时的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、QC不变,K变大,O2转化率增大 |
| B、QC不变,K变大,SO2转化率增大 |
| C、QC变小,K不变,O2转化率减小 |
| D、QC增大,K不变,SO2转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子中碳、氢原子个数比为1:2,证明乙烯分子里含有一个碳碳双键 |
B、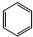 表示苯分子的结构,因此能解释邻二甲苯有 表示苯分子的结构,因此能解释邻二甲苯有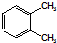 和 和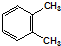 两种结构 两种结构 |
C、因为甲烷是一种正四面体结构,所以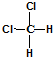 和 和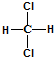 属于同一种物质 属于同一种物质 |
| D、苯的分子式是C6H6,分子式中碳原子远没有饱和,因此苯能使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com