
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- | ||
B、常温下,
| ||
| C、0.1 mol/L的NaOH溶液中:K+、AlO2-、SO42-、CO32- | ||
| D、在PH=7的溶液中:Fe3+、Na+、Br-、Cl- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


科目:高中化学 来源: 题型:
| A、H++OH-=H2O |
| B、Cl-+Ag+=AgCl↓ |
| C、Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓ |
| D、H++SO42-+OH-+Ba2+=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热的化学反应都是吸热反应 |
| B、中和反应都是放热反应 |
| C、原电池是将电能转化为化学能的一种装置 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,18g NH4+所含的电子数为10NA |
| B、56g金属铁与氯气反应时得到的电子数为3NA |
| C、标准状态下,22.4L氧气所含的氧原子数为2 NA |
| D、4.48 L H2和O2的混合气体中所含分子数约为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、英国科学家道尔顿发现了元素周期律 |
| B、研究物质性质的基本方法有实验法、观察法、分类法、比较法 |
| C、化学的特征是认识分子和制造分子 |
| D、我国科学家合成的结晶牛胰岛素是世界上首次人工合成的具有生物活性的蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
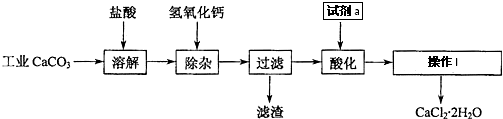
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水所含的分子数为NA | ||||
| B、17g NH3中所含的原子个数为4NA | ||||
| C、1L、1mol/L的稀盐酸中含有的氯化氢分子数为NA | ||||
D、在反应2H2O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
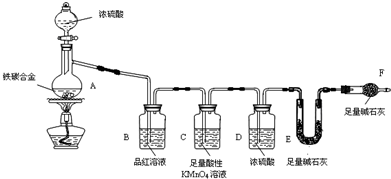
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com