


科目:高中化学 来源: 题型:
| A、H++HCO3-═H2O+CO2↑ |
| B、2HSO4-+CO32-═H2O+CO2↑+2SO42- |
| C、HSO4-+HCO3-═H2O+CO2↑+SO42- |
| D、2H++CO32-═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn与稀H2SO4 |
| B、NaCl溶液与AgNO3溶液 |
| C、H2与O2 |
| D、Na2O与H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2LN2含有的分子数为0.5NA |
| B、在常温常压下,1molHe含有的原子数为NA |
| C、1mol H2O中含有2mol氢和1mol氧 |
| D、23g钠在化学反应中失去电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- | ||
B、常温下,
| ||
| C、0.1 mol/L的NaOH溶液中:K+、AlO2-、SO42-、CO32- | ||
| D、在PH=7的溶液中:Fe3+、Na+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.112L |
| B、1.12L |
| C、0.224L |
| D、2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
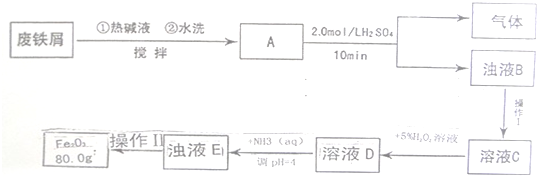
查看答案和解析>>
科目:高中化学 来源: 题型:
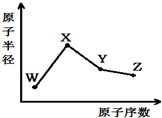 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com