
| A、6.4gO2 |
| B、1.1 gCO2 |
| C、7.2 gH2O |
| D、49 gH2SO4 |
科目:高中化学 来源: 题型:
| A、H+、Na+、CO32-、SO42- |
| B、H+、Fe3+、Cl-、I- |
| C、NH4+、Ba2+、SO42-、NO3- |
| D、Na+、K+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的直径大小在1-100nm之间 |
| B、胶体不稳定,静置后产生沉淀 |
| C、胶体的本质特征是丁达尔效应 |
| D、胶粒做不停的,无秩序的运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.01×1020个 |
| B、6.02×1021个 |
| C、7.74×1020个 |
| D、6.67×1020个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA |
| B、3.6 g重水中含有的中子数为2NA |
| C、一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA |
| D、常温下,1 L 1 mol?L-1的CH3COOH溶液中,所含溶质分子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
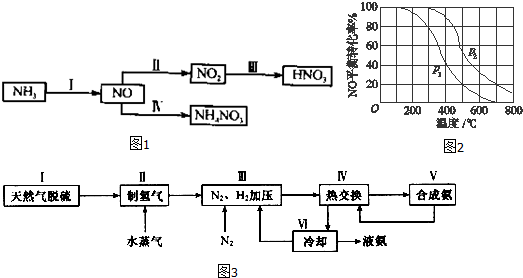
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| ②反应结束后分离出溶液备用. | |
| ③红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]. |
查看答案和解析>>
科目:高中化学 来源: 题型:
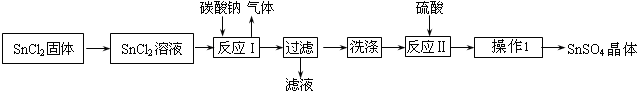
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com