
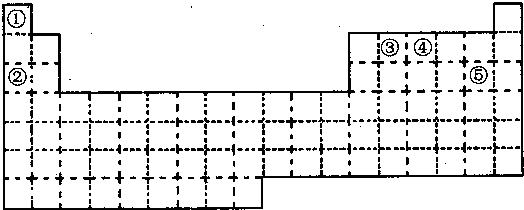
| 14Si | 15P | 16S | 17Cl | |
| 单质与H2 反应的条件 | 高温 | 磷蒸气与 H2能反应 | 加热 | 光照或点燃 时发生爆炸 |
| 最高价氧化 物的水化物 | H4SiO4 弱酸 | H3PO4 中强酸 | H2SO4 强酸 | HClO4 最强含氧酸 |
分析 (1)元素的非金属性越强,其氢化物的稳定性越强,其氢化物的还原性越弱;
(2)同一周期元素,元素的非金属性随着原子序数增大而增强;
(3)元素的非金属性越强,其单质的氧化性越强.
解答 解:(1)元素的非金属性越强,其氢化物的稳定性越强,其氢化物的还原性越弱,这几种元素非金属性强弱顺序是Cl>S>P>Si,所以稳定性最差的是SiH4,还原性最差的是HCl,故答案为:SiH4;HCl;
(2)同一周期元素,元素的非金属性随着原子序数增大而增强,原因是四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强,
故答案为:增强;四种元素原子的电子层数虽相同,但最外层电子数依次增加,随着核电荷数依次递增,原子半径依次减小,核对外层电子的引力逐渐增大,得电子能力逐渐增强,因此,非金属性逐渐增强;
(3)元素的非金属性越强,其单质的氧化性越强,非金属性Cl>S,所以氯气的氧化性大于S,所以该反应能发生,
故答案为:能够发生;因非金属性Cl>S,氧化性Cl2>S,故Cl2能置换出H2S的硫.
点评 本题考查元素周期律,明确同一周期元素非金属性强弱顺序是解本题关键,知道非金属性强弱判断方法,注意不能根据得电子多少判断,要根据得电子难易程度判断.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
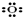 ②过氧根离子
②过氧根离子 ③氢氧根离子
③氢氧根离子 ④钠离子[Na]+
④钠离子[Na]+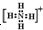 ⑦铝原子
⑦铝原子 ⑧溴负离子
⑧溴负离子
| A. | ①②③⑥⑦ | B. | ③④⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ②③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在试管口观察到红棕色气体 | 发生反应先生成NO,进而与O2反应生成NO2 |
| B | 取皂化反应的混合液滴入盛水的烧杯中,出现油滴 | 皂化反应完全 |
| C | 在溴乙烷中加入NaOH的乙醇溶液并加热,将产生的气体依次通过水、酸性KMnO4溶液,KMnO4溶液紫红色褪色 | 使KMnO4溶液褪色的气体是乙烯 |
| D | 向漂白粉溶液中通入过量的二氧化硫,溶液变浑浊 | 析出了硫酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)的密度比钠小,锂的熔沸点也比钠低 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在能使石蕊试纸变蓝色的溶液中:Na+,AlO2-,S2-,SO42- | |
| B. | 由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,CO32-,NH4+,SO32- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4 +、Na+、Fe2+、NO3- | |
| D. | pH=2的溶液中:Na+、SO42-、NO3 -、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com