
| A、8000ab/V |
| B、8000Vb/a |
| C、16000Vb/a |
| D、16000ab/V |
| 1 |
| 4 |
| bV |
| 4 |
| bV |
| 4 |
| 8bVmg |
| a×10-3L |
| 8000bV |
| a |


科目:高中化学 来源: 题型:
| A、Br- |
| B、Cl- |
| C、OH- |
| D、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、G→a→e→b→f→d→c |
| B、G→c→d→b→e→f→a |
| C、G→a→e→f→b→d→c |
| D、G→b→e→f→a→d→c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol C |
| B、1 mol B和1 mol C |
| C、2 mol A、1 mol B |
| D、3 mol A、0.5 mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KNO3溶液 |
| B、CaCl2溶液 |
| C、Na2SO4溶液 |
| D、Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
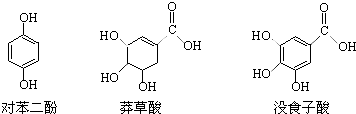
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl |
| B、KCl和KI |
| C、KCl和KBr |
| D、KCl、KBr、I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com