
| 1 |
| 2 |
| 1 |
| 2 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
| A、8000ab/V |
| B、8000Vb/a |
| C、16000Vb/a |
| D、16000ab/V |
查看答案和解析>>
科目:高中化学 来源: 题型:
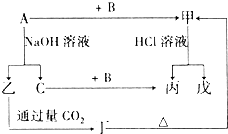 金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答:
金属单质A和非金属单质B、C及甲、乙、丙、丁、戊五种化合物有如图所示的转化关系,甲是工业上冶炼A的主要原料,丙是一种无色无味的液体.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
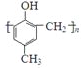 )的合成路线如下:
)的合成路线如下:
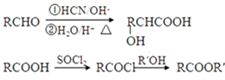 ,F分子式为C7H8O,
,F分子式为C7H8O,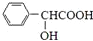 )有多种同分异构体,其中满足下述条件的同分异构体有
)有多种同分异构体,其中满足下述条件的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B和C都是固体 |
| B、B和C一定都是气体 |
| C、B和C可能都是气体 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com