
【题目】在等体积的ZnCl2、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
A.1:2:3
B.2:2:3
C.1:1:1
D.3:3:2
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
【题目】浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是

A. Fe电极的电极反应式为:Fe-2e-═Fe2+
B. 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-
C. 通入甲烷的石墨电极的电极反应式为:CH4+100H--8e-═CO32-+7H2O
D. 为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为 0.1 mol/L、体积为 V L 的氨水中逐滴加入 0.1 mol/L 的盐酸,下列 各选项中数值变大的有
![]()
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )
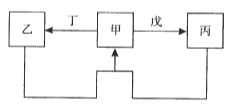
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)本生(Bunsen)热化学循环吸收SO2工艺由下列三个反应组成:
2H2(g)+O2(g)=2H2O(l) △H1=-572kJ·mol-1
2HI(g)=H2(g)+I2(g) △H2=+10kJ·mol-1
2H2SO4(l)=2SO2(g)+2H2O(l)+O2(g) △H3=+462kJ·mol-1
则得
SO2(g)+I2(g)+2H2O(I)=2HI(g)+H2SO4(I) △H=_______kJ·mol-1
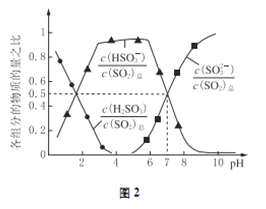
(2)氧化锌吸收法。配制ZnO悬浊液,在吸收塔中封闭循环脱硫。测得pH、吸收效率η随时间t的变化如图1所示;溶液中部分微粒与PH的关系如图2所示。
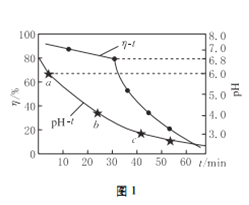
①为提高SO2的吸收效率η,可采取的措施有:增大悬浊液中ZnO的量、________________。
②图1中的pH-t曲线ab段发生的主要化学方程式为___________________
③pH=7时,溶液中![]() =________
=________
(3)如图3所示,利用惰性电解电解含SO2的烟气回收S及H2SO4,以实现废物利用。
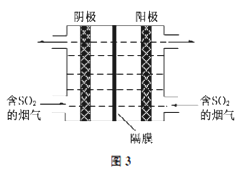
①阴极的电极反应式为_____________。
②每处理含19.2g SO2的烟气,理论上回收S、H2SO4的物质的量分别为______、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大。五种元素中,仅R为金属元素,其原子序数为27。X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个。
根据判断出的元素回答下列问题:
(1)基态R原子核外电子排布式为 ,X、Y、Z三种原子第一电离能由大到小的顺序为 (用具体元素符号表示)。
(2)1mol配合物[R(XY)6]4-中含有σ键的数目为 。
(3)XZW2是一种高毒类物质,结构与甲醛相似,X原子杂化方式为 ,其沸点高于甲醛的主要原因是 。
(4)YW3为黄色、油状、具有刺激性气味的液体,该分子的立体构型为 (用文字描述)。
(5)某晶体的晶胞结构如下图所示,则该化合物的化学式为 (R、Z用具体元素符号表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
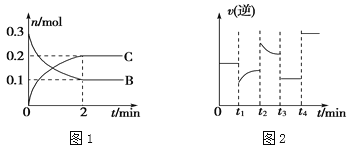
下列有关说法正确的是( )
A. x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3五种溶液, 这种试剂是
A. KSCN B. H2SO4 C. NaOH D. AgNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com