
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )
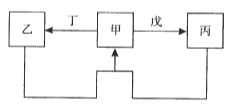
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
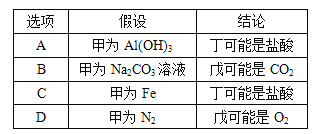
【题目】下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3 溶液中:Al3+、NH4+、SO42-、NO3-
![]()
C.使甲基橙变红的溶液中:NH4+、Cl-、SO42-、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-l3 mol/L 的溶液中:K+、Ba2+、NO3-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HClO、HNO3、KMnO4都是常见的氧化剂
B. SiO2、NO2、Al2O3都属于酸性氧化物
C. 雨后彩虹、血液透析、卤水点豆腐都属于化学变化
D. SO3、Na2O、甲苯都属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等体积的ZnCl2、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为( )
A.1:2:3
B.2:2:3
C.1:1:1
D.3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cu、CuO、CuCO3、稀H2SO4和Na2SO4溶液五种物质中,每两种物质反应能生成CuSO4的方法有( )
A.2种
B.3种
C.4种
D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(1)写出NO与活性炭反应的化学方程式______________________;
(2)计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、可持续发展密切相关,下列说法不正确的是
A.空气中PM2.5(2.5微米以下的颗粒物)的存在一定能够形成丁达尔效应
B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
C.聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子化合物材料
D.水体的富营养化与含N、P洗衣粉广泛使用有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com