
【题目】对于可逆反应:2A(g)+ B(g)![]() 2C(g),分别测定反应在不同温度下达到平衡时B 的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是( )
2C(g),分别测定反应在不同温度下达到平衡时B 的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是( )

A. 该反应的△H<0
B. b点时混合气体的平均摩尔质量不再变化
C. 增大压强,可使a点达到T1温度下平衡状态
D. c点表示的状态:v (正)> v (逆)
【答案】BD
【解析】
由图象可以看出,随着温度的升高,B的转化率增大,说明平衡向正反应方向移动,则反应为吸热反应,处于曲线上的点为平衡状态,以此解答该题。
A.随着温度的升高,B的转化率增大,说明平衡向正反应方向移动,则反应为吸热反应,△H![]() 0,故A错误;
0,故A错误;
B.b点处于平衡状态,反应物和生成物浓度不变,所以混合气体的平均摩尔质量也不再变化,故B正确;
C.增大压强平衡向正反应方向移动,B的转化率增大,而a点表示若想达到平衡,应是平衡向B的转化率减小的方向移动,应减小压强,故C错误;
D.c点不是平衡状态,要达到平衡,反应应向B的转化率增大的方向移动,即向正反应方向移动,正反应速率大于逆反应速率,故D正确。
故选BD。


科目:高中化学 来源: 题型:
【题目】面对突如其来的新冠病毒,许多化学物质发挥了非常重要作用。下列说法正确的是
A.医用酒精灭活新冠肺炎病毒是利用其氧化性
B.N95 口罩所使用的聚丙烯材料属于合成纤维
C.为增强“84”消毒液的消毒效果,可滴加浓盐酸
D.我国研制的重组新冠疫苗无需冷藏保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
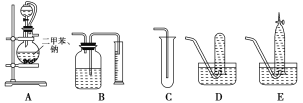
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
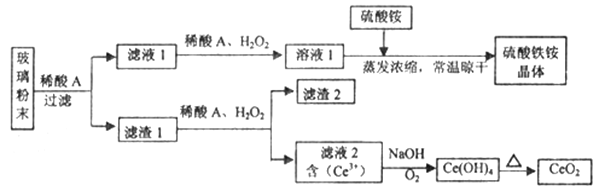
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种主族元素(过渡元素略去)在周期表中的位置如下:

(1) A的元素符号是________。
(2) D在周期表中的位置是_________________________________。
(3) E、G、T的原子半径由大到小的顺序是_________(填元素符号)。
(4)硒元素(34Se)与D同主族,其非金属性比D_________(填“强”或“弱”),从原子结构角度解释其原因:___________________________________________________________________。
(5) R元素的原子结构示意图为_________________。
(6) E、G、J三种元素最高价氧化物对应水化物两两之间能反应,离子方程式分别为:H+ +OH-=H2O、_________________________________、______________________。
(7) E、D两元素能形成原子个数比2:1和1:1的两种化合物。2:1 型化合物的电子式为______________________________。1:1型化合物的化学式以及所含化学键类型是_____________________________。
(8)A与M形成的分子可能是______________(填字母序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.某粒子空间构型为平面三角形,则中心原子一定是sp2杂化
B.某粒子空间构型为V形,则中心原子一定有孤电子对
C.某粒子空间构型为三角锥形,则该粒子一定是极性分子
D.某粒子空间构型为正四面体,则键角一定是109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A. 磁性氧化铁溶于稀硝酸:3Fe2++4H++ NO 3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
B. 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O![]() Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3![]() 2FeO42-+3Cl-+H2O+4H+
2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com