
【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
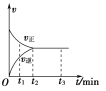
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
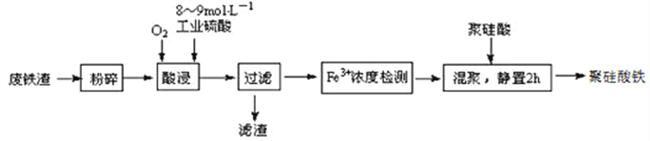
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸镓在激光材料的制备中已成为重要的基础和主要原料。以废催化剂GCS(主要成分为Ga2O3、Cr2O3和SiO2)为原料制备硝酸嫁晶体的工艺流程如下:

(1)滤渣的主要成分是______(写化学式),用稀氨水调节溶液pH至3.0~3.5之间的目的是________。
(2)用硝酸溶解时,温度应控制在40~80℃,实验室控制该温度区间的方法是______;温度高于80℃,溶解速率减慢,其原因是____________。
(3)采用减压蒸馏的目的是_________________。
(4)催化剂GCS可用于催化热乙烯还原一氧化氮,以消除尾气排放对大气的污染,写出该反应的化学方程式:________________。
(5)用硝酸镓制备含镓、铱和铂的催化剂可以有效地催化正庚烷转化为甲苯,该反应的化学方程式为________________。
(6)硝酸镓晶体加热过程中,固体失重率[失重率=![]() ]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。
]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是重要的科学研究方法,下列物质分类不正确的是
A. 电解质:明矾、一水合氨、硫酸钡
B. 酸性氧化物: ![]() 、
、![]() 、
、![]() 、
、![]()
C. 混合物:铝热剂、矿泉水、水玻璃、漂白粉
D. 同素异形体: ![]() 、
、![]() 、金刚石
、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中加入金属锌有H2放出,则在该溶液中一定能大量共存的是( )
A.Cu2+ Cl﹣ K+ SO42﹣
B.Na+ NO3﹣ OH ﹣ CO32﹣
C.Ba2+ Cl﹣ NO3﹣ SO42﹣
D.K+ Na+ Cl﹣ SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
A. 12ΔH3+5ΔH2-2ΔH1 B. 2ΔH1-5ΔH2-12ΔH3
C. 12ΔH3-5ΔH2-2ΔH1 D. ΔH1-5ΔH2-12ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:![]()
![]()
(1)恒温恒容条件下,下列能说明此反应已达平衡的是________。
①![]()
②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是_________。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(3)下图表示将![]() 和
和![]() 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, ![]() 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, ![]() 代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。
代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。

(4)一定温度下,在容积不变的密闭容器中充入![]() 和
和![]() ,达平衡时
,达平衡时![]() 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后![]() 的体积分数仍为a%的是__________。
的体积分数仍为a%的是__________。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(5)![]() 与
与![]() 反应生成
反应生成![]() ,
, ![]() 电离方程式为___________,向
电离方程式为___________,向![]() 溶液中加入
溶液中加入![]() 固体,则电离平衡往__________反应方向移动。
固体,则电离平衡往__________反应方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com