
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
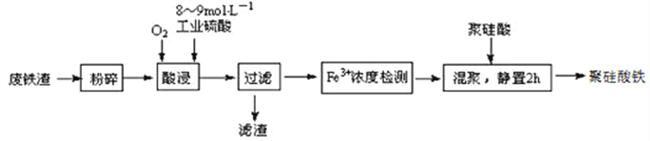
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
【答案】 增大接触面积,同时增大浸取时的反应速率和提高铁浸取率 4Fe3O4+O2+36H+=12Fe3++18H2O 小于2 pH≥2时将有部分Fe3+沉淀损失 温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低 Fe2(SO4)3 和H2SO4 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】试题分析:(1)废铁渣进行“粉碎”可以增大废铁渣与反应物的接触面积;(2)①酸浸过程中Fe3O4被氧气完全氧化为Fe3+;②Fe3+在pH=2开始沉淀,硫酸酸浸时要保证Fe3+不沉淀;③升高温度,Fe3+水解平衡正向移动;(3)废铁渣中只有Fe3O4与氧气、硫酸反应生成了Fe2(SO4)3和水;(4)在酸性条件下, Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+。
解析:(1)废铁渣进行“粉碎”可以增大废铁渣与反应物的接触面积,增大浸取时的反应速率和提高铁浸取率;(2)①酸浸过程中Fe3O4被氧气完全氧化为Fe3+,反应离子方程式是4Fe3O4+O2+36H+=12Fe3++18H2O;②Fe3+在pH=2开始沉淀,硫酸酸浸时要保证Fe3+不沉淀,所以要控制PH小于2;③升高温度,Fe3+水解平衡正向移动,生成氢氧化铁,所以温度超过100℃时,铁浸取率反而减小;(3)废铁渣中只有Fe3O4与氧气、硫酸反应生成了Fe2(SO4)3和水,所以滤液的成分是Fe2(SO4)3 和H2SO4;(4)在酸性条件下, Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有SO42-、CO32-、Cl-三种阴离子。
如果每次只检验一种离子,完成下面的填空。
(1)先检验CO32-,加入________试剂(或溶液),反应的离子方程式为_____。
(2)然后检验SO42-,加入________试剂(或溶液),反应的离子方程式为___。
(3)最后检验Cl-,加入________试剂(或溶液),反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As的化合物在研究和生产中有许多重要用途。
(1)基态As原子的核外电子排布式为_________。
(2)N的第一电离能比O大,原因是______________。
(3)NH4+中H-N-H的键角比NH3中H-N-H 的键角_______(填“大”或“小”),原因是____________。
(4)K3AsO4中含有的化学键类型包括________;AsO43- 的空间构型为______。As4O6的分子结构如图1所示,则该化合物中As的杂化方式是__________。
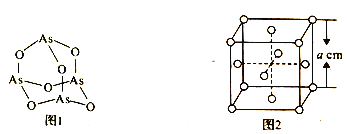
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5 是_______晶体。
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2 (小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数的数值为NA,则该晶胞中含有P 原子的个数为______,该晶体的密度为_________(用含NA、a 的代数式表示) g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香蕉果实成熟过程中由于储存的物质变为可溶性糖从而使果实甜度增加。某兴趣小组对此生理变化进行了初步探究:取未成熟香蕉果实若干放在适宜条件下让其自然成熟,每天定时取10 g果肉研磨配制成100 mL待测样液平分为A、B两份,分别用碘液和斐林试剂检测,记录颜色深浅的变化。
(1)样液A用碘液检测的目的是__________________;样液B用斐林试剂检测的目的是___________。
(2)斐林试剂使用时需甲、乙液等量混合均匀后再注入,并____________观察颜色变化。
(3)根据预期结果在坐标图中画出两种颜色的变化。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
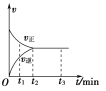
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com