
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 无水AlCl3 |
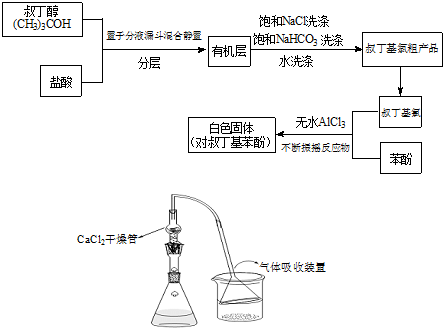
 +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
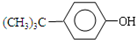 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 体系 pH[ |
不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
| 10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
| 12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
| 14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极的电极反应式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是_______。研究亦发现,铁电极在某一电压范围内会生成Fe2O3膜而“钝化”,原因可能是__ ____。
(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图1中4 h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1 h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是( )

A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6 h后电流效率几乎为0
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2)。随温度升高,高铁酸盐产率先增大后减小的原因是 。

(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于( )
A.将1 mol Fe3O4氧化成高铁酸盐需10/3 mol电子,可提高电流效率
B.以低价态铁的氧化物为电极,可以实现变废(铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现“钝化”现象
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量,对反应N2(g)+3H2(g) 2NH3(g)
ΔH=-92.4
kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)
ΔH=-92.4
kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)

①图像中T2和T1的关系是:T2 T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,N2的转化率最高的是 (填字母)。
③要使反应后氨的百分含量最大,则在起始体系中原料投料比n(H2)/n(N2) 3(填 “>”、“<”、“=”或“无法确定”)。若容器容积恒为1 L,起始状态n(H2)=3 mol,反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。(结果保留小数点后两位)
(2)已知:N2(g)+O2(g) 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
今有17 g氨气,假设其经催化氧化完全反应,生成一氧化氮气体和水蒸气,则该过程中所放出的热量为 kJ。
(3)在装置②中,NH3和O2从145℃就开始下列反应,在不同温度和催化剂条件下生成不同产物(如下图所示):

温度较低时生成 为主,温度高于900℃时,NO产率下降的可能原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com