
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1-36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
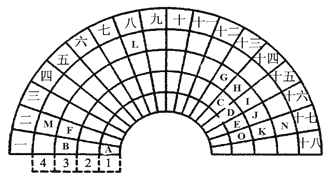
(1) D代表的元素处于常见元素周期表的位置是第 _____ 周期________ 族。
(2)元素F、G、I、K、M的原子半径由大到小的顺序是___________________(用元素符号表示)。
(3)B、F、G三种元素三种元素最高价氧化物对应水化物碱性最强的碱是_________(填化学式)。
【答案】第二周期 ⅤA 族 Ca>Mg>Al>P>Cl NaOH
【解析】
A在第一周期第一列,A是H元素;B在第三周期第一列,B是Na元素;C、D、E、O分别在第二周期第14、15、16、17列,C、D、E、O分别是C、N、O、F元素;
F、G、H、I、J、K分别在第三周期第2、13、14、15、16、17列,F、G、H、I、J、K分别是Mg、Al、Si、P、S、Cl元素;M、L、N分别在第四周期第2、8、17列,M、L、N分别是Ca、Fe、Br。
根据以上分析,(1) D是N元素,处于常见元素周期表的位置是第二周期ⅤA 族。
(2)元素F、G、I、K、M分别是Mg、Al、P、Cl、Ca,电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径由大到小的顺序是Ca>Mg>Al>P>Cl。
(3)B、F、G三种元素分别是Na、Mg、Al,三种元素都处于第三周期,金属性由强到弱的顺序为Na>Mg>Al,金属性越强,元素最高价氧化物对应水化物碱性越强,碱性最强的碱是NaOH。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】元素化学性质发生周期变化性质变化的根本原因是
A.元素的原子半径呈周期性的变化
B.元素的化合价呈现周期性变化
C.元素原子核外电子排布呈现周期性变化
D.元素的金属性和非金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是________,只有还原性的是________,既有氧化性又有还原性的是________。
(2)某同学写出以下三个化学方程式(未配平)
①NO+HNO3→N2O3+H2O ②NH3+NO→HNO2+H2O ③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是________。
(3)下列三个氧化还原反应中,氧化性最强的物质是________。
①2FeCl3+2KI===2FeCl2+2KCl+I2 ②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若溶质中Cl-与I-共存,为了氧化I-而Cl-不被氧化,除单质外,还应用上述反应中的________作氧化剂。
(4)请配平以下化学方程式:___
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH===
NaOH===![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a An+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
A. 原子序数:b>a>c>dB. 最高价氧化物对应水化物的碱性:B>A
C. 四种离子的电子层结构相同,因而离子的性质也相同D. 气态氢化物的稳定性:D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置模拟生成过程。
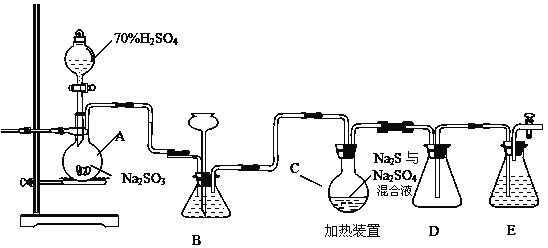
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 __________________________,则整个装置气密性良好。装置D的作用是___________________________。装置E中为___________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为______________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择__________ 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)实验中,为使SO2缓慢进入烧瓶C,采用的操作是____________。
(5)已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是_______________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有___________________。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类或变化说法正确的是
A. NaCl溶液是强电解质
B. 二氧化氮经加压凝成无色液体为物理变化
C. Na2OSiO2是硅酸盐,可溶于水
D. 溴水滴入植物油中褪色说明溴被植物油萃取出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Br-、Cu2+D.Na+、Ba2+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时在2L密闭容器内反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,用O2表示从0~2s内该反应的平均速率v(O2)=____________。

(3)能说明该反应一定达到平衡状态的是_____________。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率的是___________________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com