
【题目】800℃时在2L密闭容器内反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,用O2表示从0~2s内该反应的平均速率v(O2)=____________。

(3)能说明该反应一定达到平衡状态的是_____________。
a.v(NO2)=2v(O2) b.容器内颜色保持不变
c.2v逆(NO)=v正(O2) d.容器内压强保持不变
(4)能增大该反应的反应速率的是___________________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】 65% b 1.5×10—3mol·L-1·s-1 bd bcd
【解析】(1)NO的转化率等于平衡时消耗的NO的物质的量与起始时NO的物质的量的比值;
(2)计算平衡时NO2的物质的量结合图像判断;根据v=△c/△t计算;
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。
(4)根据外界条件对反应速率的影响分析。
(1)根据表中数据可知达平衡时消耗NO的物质的量是0.02mol-0.007mol=0.013mol,所以NO的转化率为0.013mol/0.020mol×100%=65%;
(2)反应是从正反应方向开始的,NO的起始浓度是0.02mol÷2L=0.010mol/L。NO的平衡浓度是0.007mol÷2L=0.0035mol/L,根据方程式可知平衡时生成的NO2的浓度是0.01mol/L-0.0035mol/L=0.0065mol/L,故图中表示NO2的变化的曲线是b。从0~2s内消耗NO是0.02mol-0.008mol=0.012mol,则根据方程式可知消耗氧气是0.012mol÷2=0.006mol,浓度是0.006mol÷2L=0.003mol/L,则v(O2)=0.003mol/L÷2s=1.5×10—3mol·L-1·s-1;
(3)a.在任何时刻都存在v(NO2)=2v(O2),所以不一定达到平衡,a错误;
b.若容器内颜色保持不变,则NO2的浓度不变,反应达到平衡状态,b正确;
c.在任何时刻都存在v逆(NO)=2V逆(O2),若2v逆(NO)=v正(O2),则v正(O2)=4v逆(O2),反应未达到平衡,c错误;
d.由于该反应是反应前后气体体积不等的反应,所以若容器内压强保持不变,则反应达到平衡,d正确。
答案选bd;
(4)a.及时分离出NO2气体,由于物质的浓度减小,所以化学反应速率减慢,a错误;
b.适当升高温度,可以加快反应速率,b正确;
c.增大反应物O2的浓度,可以加快化学反应速率,c正确;
d.选择高效催化剂,可以成千上万倍的加快化学反应速率,d正确。
答案选bcd。


科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1-36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
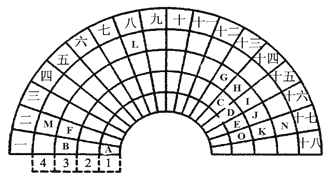
(1) D代表的元素处于常见元素周期表的位置是第 _____ 周期________ 族。
(2)元素F、G、I、K、M的原子半径由大到小的顺序是___________________(用元素符号表示)。
(3)B、F、G三种元素三种元素最高价氧化物对应水化物碱性最强的碱是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能够大量共存且溶液呈无色的是
A.H+、Ag+、Cl-、SO42-B.Mg2+、Al3+、OH-、SO42-
C.K+、Na+、Cl-、CO32-D.NH4+、MnO4-、Na+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________。
(2)步骤Ⅱ吸收Br2,有关反应的化学方程式为___________________________,由此反应可知,除环境保护外,在工业生产中还应解决的主要问题是_________________。
(3)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了装置简图:

请你参与分析讨论:
①图中仪器B的名称是____________________。
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚经下列反应可制香料M和高分子化合物N(部分产物及反应条件已略去)
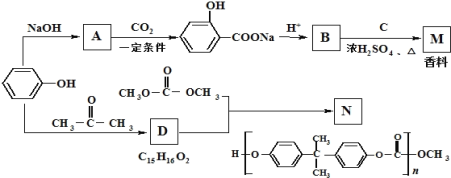
(1)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种,则C的结构简式为 ________.
(2)由D生成N的反应类型是_________.
(3)由苯酚生成D的化学方程式是_________.
(4)F是分子量比B大14的同系物,则F的分子式是__________________ .F有多种同分异构体,符合下列条件的F的同分异构体有_______ 种
①遇FeCl3溶液显紫色,且能水解②苯环上有两个取代基,且苯环上的一溴代物只有两种。
(5)已知: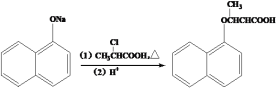 ,写出以苯酚、乙醇和CH2ClCOOH为原料制备
,写出以苯酚、乙醇和CH2ClCOOH为原料制备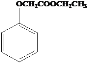 的合成路线流程图(无机试剂任用)_________。
的合成路线流程图(无机试剂任用)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
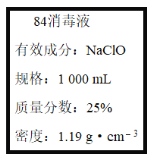
(1)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是____(填字母)。
a.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
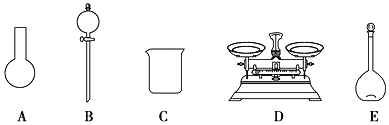
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
d.需要称量NaClO固体的质量为143.0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):
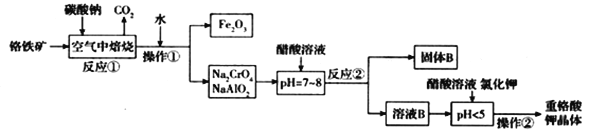
(1)反应①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”)。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ____________________。
(3)加入醋酸溶液,调节溶液的pH < 5时,发生的反应是___________(写离子方程式).
(4)下表是相关物质的溶解度数据:
物质 | 溶解度( g / 100 g H2O ) | ||
0 ℃ | 40 ℃ | 80 ℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①调节pH < 5后,加入KCl固体经一系列操作析出K2Cr2O7晶体的理由是______________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的CrO5,该反应可用来检验Cr2O72的存在。已知该反应是非氧化还原反应,写出反应的离子方程式:________________,CrO5分子结构中过氧键的数目是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com