
【题目】下列气体不会造成空气污染的是( )
A.N2B.COC.NO2D.SO2
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】I.玫瑰的香味物质中包含苧烯,苧烯的键线式为![]()
(1)写出苧烯跟等物质的量的Br2发生加成反应所得产物的可能的结构:________________________(用键线式表示)。
(2)有机物A是苧烯的同分异构体,分子中含有![]() 结构,A可能的结构有____种。
结构,A可能的结构有____种。
II.某烃键线式为![]() ,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
,该烃与Br2以物质的量之比1: l加成时,所得产物有_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则K2=_______ (用含K1、K3、K4的代数式表示)
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g) ![]() CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
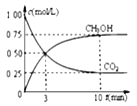
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下列各图所示是中学化学中常用于混合物分离和提纯的装置:
A. 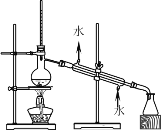 B.
B. 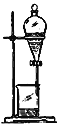
C.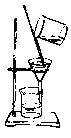 D.
D. 
请根据装置图回答下列问题:
⑴A图中用于盛放液体混合物的仪器的名称为:__________________
⑵选择合适的实验装置分离以下混合物(填代表装置的字母),
①从碘水中分离出I2 : ___________
②进行酒精和水的分离: ___________
③二氧化锰和蔗糖溶液: ___________
⑶我国具有历史悠久的酒文化,请回答下列问题:
①要提高酒精的度数,可采用的方法是________________(填操作方法,下同)
②中药常常浸泡在美酒中制成药酒,你认为利用的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
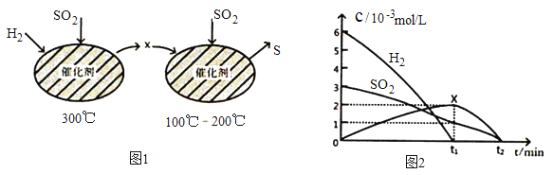
①分析可知X为____________(写化学式),0~t1时间段的温度为_________,0~t1时间段用SO2表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,比较Na2SO3溶液中各离子浓度的大小关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,22.4L氨气溶于足量水后含有NA个分子
B. lmol/L的NaClO溶液中含有CIO-的数目小于NA
C. 60gSiO2中含有4molSi-O键
D. lmolN2和4molH2充分反应生成NH3时转移电子总数是6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氮化铝(AlN)溶于强酸产生铝盐,溶于强碱生成氨气。
(1)AlN与NaOH溶液反应的化学方程为_______。
(2)甲同学通过测定AlN与NaOH溶液反应产生氨气的质量来测定AlN的纯度(假设杂质不参与反应,忽略NH3在强碱性溶液中的溶解)。实验装置如下:

①选择上图中合适的装置,其连接顺序为______(按气流从左到右方向,填字母)。
②装置A中干燥管的作用是________。
(3)乙同学通过测定氨气体积来测定AlN的纯度。

①导管a的作用是________。
②读数前,需要进行的操作是_______。
③若称取样品的质量为mg,量气管中测定的气体体积为VmL,该实验条件下的气体摩尔体积为VmL/mol,则AlN的质量分数为______;若读取量气管中气体的体积时,液面左高右低,则测得的AlN的纯度______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com