
(1)得到高纯度的固体烧碱,含杂质NaCl 0.1% 以下,NaClO3极微量,隔膜法产品含上述杂质分别为:0.1%~1.2%和0.1%~0.3%。
(2)得产品浓度:烧碱液(含NaOH 35%~48%;隔膜法产品含NaOH约10%),大大降低用于蒸发浓缩的能量消耗。
(3)要求高浓度的原料食盐水中所含钙、镁等金属离子的总量控制在0.1 ppm以下。
请根据食盐水电解的两极反应和副反应,离子迁移和放电及上述两种膜(交换膜和隔膜)的性能,简单说明离子交换膜电解槽具有上述特点的原因。
解析:本题以电解食盐水制取烧碱为题材(中学学习过隔膜法电解食盐水制烧碱的原理),介绍了离子交换膜的性能,简述离子交换膜电解槽的特点,要求根据两极反应、副反应、离子迁移,膜的性能对具有这些特点的原因进行解释,这为我们分析问题提出了思路。
(1)对产品纯度的分析。离子膜法和隔膜法比较,其相同点有:
①原料食盐水都从阳极区加入。
②两极反应相同。
阳极:2Cl--2e-====Cl2↑阴极:2H++2e-====H2↑
③NaOH都由阴极区生成(这是因为H+在阴极上获得电子,放出H2,破坏阴极附近水的电离平衡,促进水不断电离出H+和OH-,结果溶液中OH-数目不断增多)。离子膜法和隔膜法的不同点是:膜的性能不同。隔膜虽能阻止气体分子通过,但不能阻止离子穿过,因此,阳极原料食盐水中的Cl-可穿过膜进入阴极区,故产品中NaCl含量高,阴极区生成的OH-也可穿过隔膜进入阳极区,与阳极生产的Cl2发生下列反应:
3Cl2+6NaOH(热)====5NaCl+NaClO3+3H2O
(2)对产品浓度的分析。电解时,阳极上发生的副反应主要是:4OH--4e-====O2↑+2H2O,OH-离子失电子倾向随OH-离子浓度的增大而增大,由于OH-能透过隔膜从阴极区顺利到达阳极区,为了减少副反应,因此隔膜法产品中NaOH的质量分数控制在1%左右;因为OH-很难穿过离子膜,因此用离子膜法生产烧碱不必控制OH-的离子浓度,可以得到高浓度的NaOH产品。
(3)对控制原料食盐水中Ca2+、Mg2+总量分析。两种膜都能允许阳离子穿过,由于离子膜法阴极区NaOH的浓度较高,更容易与微量的Mg2+、Ca2+发生离子反应而生成沉淀物,造成膜的堵塞,因此离子膜法对原料食盐水中Ca2+、Mg2+总含量要求控制得更小。
答案:(1)①NaCl杂质:阴极区原料食盐水中的Cl-较难通过离子交换膜,因此烧碱产品中NaCl杂质少,隔膜法中未反应的Cl-可顺利通过膜到达阳极室,所以烧碱产品中含NaCl较多。②NaClO3杂质:隔膜法阳极室中生成的Cl2与阴极室透过膜到达阳极室的OH-发生下列反应:3Cl2+6OH-====ClO![]() +5Cl-+3H2O,而离子膜法中OH-很难透过膜。
+5Cl-+3H2O,而离子膜法中OH-很难透过膜。
(2)在离子膜法中,从阳极室取出的烧碱液浓度随电解进行而增大,并加水调节浓度;隔膜法中阴极液是NaOH和NaCl混合液,过度电解会使副反应加剧,因此电解到含NaOH约10%(此时含NaCl 15%),取出蒸发浓缩。
(3)不仅Na+能通过阳离子交换膜,Ca2+、Mg2+等金属离子也能通过,当Ca2+、Mg2+通过膜到达阴极室时,与OH-形成难溶化合物,造成堵塞,影响膜性能的发挥。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| A、高纯度的硅单质广泛用于制作光导纤维 | B、向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染 | C、将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管 | D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三12月调研考试化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法正确是( )
A.高纯度的硅单质广泛用于制作光导纤维
B.向煤中加入适量石灰石,在煤燃烧时SO2最终生成CaSO4,可减少对大气的污染
C.将盛满二氧化氮气体的试管倒立在水中,可观察到溶液充满试管
D.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)有科学家提出硅是“21世纪的能源”、“未来的石油”,硅单质及其化合物应用范围很广,制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
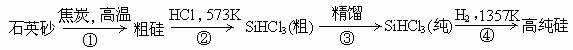
请回答下列问题:
(1)写出第①步的化学反应方程式___________________________;
(2)下列有关硅材料的说法正确的是________________(填字母):
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.硅可做“未来的石油”,可能的原因之一是燃烧放出的热量多,且燃烧产物对环境污染程度低,容易有效控制
C.普通玻璃是由烧碱、石灰石和石英砂制成的,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
E.高纯度硅可直接用于制造高性能通讯材料——光导纤维
F. 氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
(3)SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式_______________________________________;
(4)单质硅遇到氢氧化钠溶液会完全溶解得到无色溶液并放出无色气体,请写出该反应的离子方程式________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com