
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g).图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )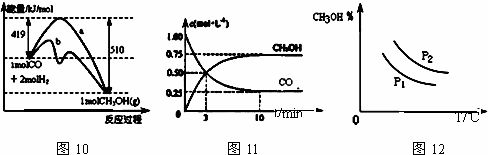
|
| A. | CO和H2合成CH3OH的反应:△H<0,△S>0 |
|
| B. | 保持温度不变,再充入1mol CO和2mol H2,反应达到新平衡时 |
|
| C. | 图10中曲线b可表示使用了催化剂的能量变化情况 |
|
| D. | 图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
考点:
反应热和焓变;物质的量或浓度随时间的变化曲线;产物的百分含量随浓度、时间的变化曲线.
专题:
图示题.
分析:
A.该反应是放热反应,焓变小于0,反应前后气体体积减小,气体体积减小则熵减;
B.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动;
C.使用催化剂能改变反应途径,但不影响平衡移动;
D.根据温度和压强对化学平衡的影响分析.
解答:
解:A.该反应是一个反应前后气体体积减小的放热反应,所以△H<0,△S<0,故A错误;
B.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时 会增大,故B错误;
会增大,故B错误;
C.使用催化剂能降低反应需要的活化能从而改变反应途径,但不影响平衡移动,所以放出的能量不变,故C正确;
D.该反应是一个反应前后气体体积减小的放热反应,升高温度平衡向逆反应方向移动,则甲醇的含量减少,增大压强平衡向正反应方向移动,乙醇的含量增大,故D正确;
故选AB.
点评:
本题考查化学平衡及能量变化,学生应根据图象来分析解决问题,图象中的信息是解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
热化学方程式C(s)+H2O(g)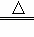 CO(g)+H2(g);△H=+131.3kJ/mol表示( )
CO(g)+H2(g);△H=+131.3kJ/mol表示( )
|
| A. | 碳和水反应吸收131.3kJ能量 |
|
| B. | 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
|
| C. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
|
| D. | 1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是( )
|
| A. | 200mL0.5mol/LNaCl溶液 | B. | 100mL1mol/LNa2CO3溶液 |
|
| C. | 100mL0.5mol/LNa3PO4溶液 | D. | 1L1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,某溶液中由水电离出的c(OH﹣)=10﹣5 mol•L﹣1,则其溶质可能是( )
|
| A. | CH3COOH | B. | H2SO4 | C. | NaOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:
CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡 ,c(CO) .
(2)减小密闭容器的体积,保持温度不变,则平衡 ,c(CO2) .
(3)通入N2,保持密闭容器的体积和温度不变,则平衡 ,c(CO2) .
(4)保持密闭容器的体积不变,升高温度,则平衡 ,c(CO)
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程或现象与盐类水解无关的是( )
|
| A. | 热的Na2CO3溶液可以除去油污 |
|
| B. | ZnCl2和NH4Cl溶液可作金属焊接中的除锈剂 |
|
| C. | 用食醋除水垢 |
|
| D. | 将AlCl3溶液加热蒸干、灼烧,最后得到的固体时Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是 溶液,D是 溶液.
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是 .
A.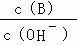 B.
B.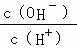 C.c (H+)•c (OH﹣) D.n (OH﹣)
C.c (H+)•c (OH﹣) D.n (OH﹣)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则 (填化学式)溶液中锌粉有剩余.
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 .
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10﹣7mol/L,则 Ksp[Mg(OH)2]= .
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关溶液(均在常温下)的结论正确的是( )
|
| A. | pH=1的盐酸与pH=5的盐酸等体积混合后pH=3 |
|
| B. | 0.1mol/L醋酸溶液100 mL与0.2 mol/L氨水50 mL混合后能恰好完全中和 |
|
| C. | pH>7的溶液中不可能存在CH3COOH分子 |
|
| D. | 等浓度等体积的KOH溶液和CH3COOH溶液混合后:c(CH3COO﹣)=c(K+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com