
下列溶液一定呈酸性的是( )
|
| A. | pH小于7的溶液 | B. | 含有H+的溶液 |
|
| C. | 滴加酚酞显无色的溶液 | D. | c(H+)>c(OH﹣)溶液 |
考点:
溶液pH的定义.
专题:
电离平衡与溶液的pH专题.
分析:
A.溶液的酸碱性取决于溶液中C(H+)和c(OH﹣)的相对大小,与溶液的pH大小无关;
B.任何水溶液中都含有氢离子;
C.常温下,酚酞试液的变色范围是8﹣10,其颜色分别为无色、浅红色、红色;
D.溶液的酸碱性取决于溶液中C(H+)和c(OH﹣)的相对大小.
解答:
解:A.溶液的酸碱性取决于溶液中C(H+)和c(OH﹣)的相对大小,与溶液的pH大小无关,所以pH小于7的溶液不一定是酸溶液,故A错误;
B.无论酸、碱还是盐溶液中都含有氢离子,所以不能根据是否含有氢离子判断溶液的酸碱性,故B错误;
C.常温下,酚酞试液的变色范围是8﹣10,其颜色分别为无色、浅红色、红色,所以溶液颜色为无色时,溶液可能呈碱性或中性,故C错误;
D.溶液的酸碱性取决于溶液中C(H+)和c(OH﹣)的相对大小,当溶液中C(H+)>c(OH﹣)时,溶液呈酸性,当C(H+)=c(OH﹣)时溶液呈中性,当C(H+)<c(OH﹣)时,溶液呈碱性,故D正确.
故选D.
点评:
本题考查了溶液酸碱性的判断,难度不大,注意溶液的酸碱性取决于溶液中C(H+)和c(OH﹣)的相对大小,与溶液的pH大小无关.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在CH3COOH⇌H++CH3COO﹣的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取措施是( )
|
| A. | 加入NaOH | B. | 加入盐酸 | C. | 加水 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
|
| A. | 2912kJ | B. | 2953kJ | C. | 3236kJ | D. | 3867kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
H2A为弱电解质,0.1mol/LH2A水溶液加水稀释为0.01mol/L时,下列各粒子的浓度减小最多的是( )
|
| A. | A2﹣ | B. | HA﹣ | C. | H+ | D. | H2A |
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL0.001mol/L盐酸的pH=
50mL0.001mol/LNaOH溶液的pH=
100℃时,水的Kw=1×10﹣12,则该温度下,纯水的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+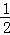 O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+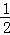 O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
|
| A. | ① | B. | ④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产甲醇的反应为CO(g)+2H2(g)⇌CH3OH(g).图10表示反应中能量的变化;图11表示一定温度下,在体积固定为2L的密闭容器中加入4mol H2和一定量的CO(g)后,CO(g)和CH3OH(g)的浓度随时间的变化图.下列叙述错误的是( )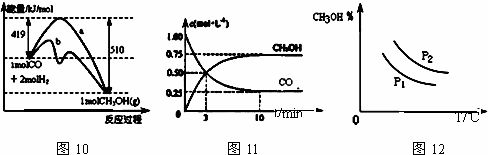
|
| A. | CO和H2合成CH3OH的反应:△H<0,△S>0 |
|
| B. | 保持温度不变,再充入1mol CO和2mol H2,反应达到新平衡时 |
|
| C. | 图10中曲线b可表示使用了催化剂的能量变化情况 |
|
| D. | 图12中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
①该反应能否自发进行与___________有关。
②一定温度下,在一个容积可变的密闭容器中, 发生上述反应,下列能判断该反应达到化学平衡状态的是___________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O CO2(g)+H2 (g),得到如下三组数据:
CO2(g)+H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为__________(填”吸”或”放”)热反应。
③若使实验3达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min, 则a、b应满足的关系是______________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
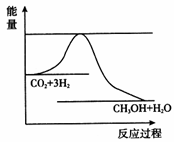
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com