
50mL0.001mol/L盐酸的pH=
50mL0.001mol/LNaOH溶液的pH=
100℃时,水的Kw=1×10﹣12,则该温度下,纯水的pH= .
考点:
物质的量浓度的相关计算.
专题:
计算题.
分析:
先计算c(H+),利用pH=﹣logc(H+)计算50mL0.001mol/L盐酸的pH值;
先计算c(OH﹣),根据Kw=c(H+)•c(OH﹣)=1×10﹣14,计算溶液中c(H+),再利用pH=﹣logc(H+);
纯水溶液中c(H+)=c(OH﹣),根据Kw=c(H+)•c(OH﹣)=1×10﹣12,计算溶液中c(H+),再利用pH=﹣logc(H+).
解答:
解:50mL0.001mol/L盐酸溶液中c(H+)=c(HCl)=1×10﹣3mol/L,所以该溶液的pH=﹣log1×10﹣3=3;
50mL0.001mol/LNaOH溶液中c(OH﹣)=c(NaOH)=1×10﹣3mol/L,所以c(H+)=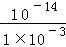 mol/L=1×10﹣11mol/L,所以该溶液的pH=﹣log1×10﹣11=11;
mol/L=1×10﹣11mol/L,所以该溶液的pH=﹣log1×10﹣11=11;
100℃时,水的Kw=1×10﹣12,则c(H+)•c(OH﹣)=1×10﹣12,纯水中c(H+)=c(OH﹣),所以c(H+)=c(OH﹣)=1×10﹣6mol/L,该温度下,所以纯水的pH=﹣log1×10﹣6=6;
故答案为:3;11;6.
点评:
本题考查溶液pH值的计算、水的离子积等,比较基础,注意基础知识的掌握.


科目:高中化学 来源: 题型:
体积相同的甲.乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2⇌2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
|
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对某一可逆反应来说,使用催化剂的作用是( )
|
| A. | 提高反应物的平衡转化率 |
|
| B. | 以同样程度改变正逆反应的速率 |
|
| C. | 增大正反应速率,减小逆反应速率 |
|
| D. | 改变平衡混合物的组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生.下列能源符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能.
|
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是( )
|
| A. | 200mL0.5mol/LNaCl溶液 | B. | 100mL1mol/LNa2CO3溶液 |
|
| C. | 100mL0.5mol/LNa3PO4溶液 | D. | 1L1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:
CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡 ,c(CO) .
(2)减小密闭容器的体积,保持温度不变,则平衡 ,c(CO2) .
(3)通入N2,保持密闭容器的体积和温度不变,则平衡 ,c(CO2) .
(4)保持密闭容器的体积不变,升高温度,则平衡 ,c(CO)
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应的离子方程式的书写中,正确的是
A.C12通入水中:C12+H2O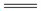 2H++Cl-+ClO-
2H++Cl-+ClO-
B.硫酸铝溶液与过量氨水反应:Al3++3NH3·H2O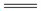 3
3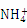 +Al(OH)3↓
+Al(OH)3↓
C.实验室用石灰石和盐酸反应制取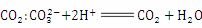
D.向Na2SO3溶液中加入稀硝酸:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com