
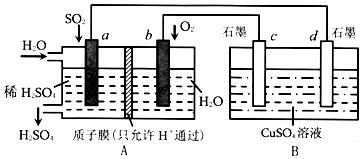
分析 A装置能自发的进行氧化还原反应且没有外接电源,所以原电池,则a通二氧化硫为负极发生氧化反应,b通氧气为正极发生还原反应,B属于电解池,与a相连的d为阴极得电子发生还原反应,与b相连的c为阳极失电子发生氧化反应,据此分析解答.
解答 解:①根据以上分析,A装置为原电池,H+移向正极b,与b相连的c为阳极,故答案为:b;阳极;
②a通二氧化硫为负极发生氧化反应,电极反应式为SO2-2e-+2H2O=4H++SO42-,故答案为:SO2-2e-+2H2O=4H++SO42-;
③与b相连的c为阳极失电子发生氧化反应,电极反应式为4OH--4e-=O2+2H2O,故答案为:4OH--4e-=O2+2H2O;
④根据a通二氧化硫为负极发生氧化反应,电极反应式为SO2-2e-+2H2O=4H++SO42-,当标准状况下,A装置吸收3.36LSO2时,则转移电子数为:$\frac{3.36L}{22.4L/mol}$×2=0.3mol,B属于电解池即惰性电极电极硫酸铜溶液,阳极电极反应式为4OH--4e-=O2+2H2O放出氧气,阴极Cu2++2e-=Cu析出铜,所以B装置中溶液最多减重$\frac{0.3}{4}$×32+$\frac{0.3}{2}$×64=12(g),故答案为:12.
点评 本题考查了原电池和电解池原理,根据是否自发进行判断原电池和电解池,再结合各个电极上发生的电极反应分析解答,难点是电极反应式的书写,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
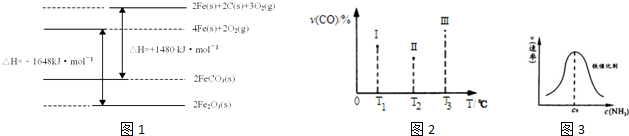
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | B. | S2-的结构示意图: | ||
| C. | HF的电子式: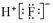 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-) | |
| B. | 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下用焦炭还原SiO2制取粗硅 | |
| B. | 晶体硅熔点高硬度大,因此可用于制作半导体材料 | |
| C. | 石英只能用于生产光导纤维 | |
| D. | 玻璃容器可长期盛放各种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com