
 H>0,下列叙述正确的是
H>0,下列叙述正确的是| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低 |
| D.将水加热,Kw增大,c(H+)不变 |
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:不详 题型:单选题
 2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
| A.点a的正反应速率比点b的大 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.醋酸与锌反应放出氢气多 |
| B.盐酸和醋酸分别与锌反应放出的氢气一样多 |
| C.刚开始反应时,醋酸与锌反应速率小 |
| D.盐酸和醋酸分别与锌反应的平均速率一样大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%,
2Z(g) + R(g),反应平衡时,则知X 和Y 的转化率分别为30%和60%, | A.1 | B.2 | C.3 | D.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应:2CO(g)+2NO(g) |
| B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| C.铅蓄电池放电时,正极和负极均有硫酸铅生成 |
D.反应:2A(g)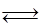 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
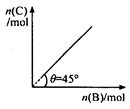
 4C(g) + D ( g );△H < 0 。
4C(g) + D ( g );△H < 0 。A.平衡 时B的转化率为33.3 % 时B的转化率为33.3 % |
| B.若再加入B,则再次达到平衡时正.逆反应速率均增大,但仍然相等 |
| C.若再加人4molC和1molD ,则再次达到平衡时体系气体密度减小,平均摩尔质量不变 |
| D.若温度变为(t+10)℃,则θ<45° |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com