
| 容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
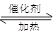 4NO + 6H2O(3分)
4NO + 6H2O(3分) 4NO + 6H2O
4NO + 6H2O 2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。
2NO2,根据图像可判断,反应是放热反应。所以要提供转化率可以通过降低温度,或增大压强来提供转化率。催化剂不能影响平衡状态,转化率不变,增加C的物质的量,平衡向正反应方向移动,但C的转化率会降低。 2NO2
2NO2
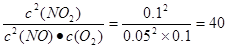 。在Ⅱ
。在Ⅱ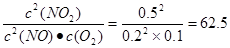 >40,所以正反应速率小于逆反应速率。在Ⅲ
>40,所以正反应速率小于逆反应速率。在Ⅲ <40,所以正反应速率大于逆反应速率。
<40,所以正反应速率大于逆反应速率。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源:不详 题型:填空题
 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
 2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度 。(此温度下不考虑O2与NO的反应,计算结果保留两位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )| A.用物质A表示的反应的平均速率为0.3 mol?L-1?s-1 | B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% | D.2s时物质B的浓度为0.7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g)
2C(g) 
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
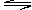 nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min
nZ(g)+2W(g) , 5 min末反应达到平衡状态,此时已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物[ |
| C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O MgCl2+6H2O |
| B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。 化学式 电离常数 HClO K1=3×10-8 H2CO3 K1=4.3×10-7 K2=5.6×10-11 |
| C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。 |
| D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数CKsp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H>0,下列叙述正确的是
H>0,下列叙述正确的是| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量固体NaOH,平衡逆向移动,c(OH-)降低 |
| D.将水加热,Kw增大,c(H+)不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com