
【题目】某溶液中大量存在以下浓度的五种离子:0.2 mol/L Cl、0.4 mol/L![]() 、0.1 mol/L Al3+、0.3 mol/L H+、一定物质的量浓度的M,则M及其物质的量浓度可能为
、0.1 mol/L Al3+、0.3 mol/L H+、一定物质的量浓度的M,则M及其物质的量浓度可能为
A.![]() 0.4 mol/LB.Na+ 0.3 mol/L
0.4 mol/LB.Na+ 0.3 mol/L
C.Zn2+ 0.2 mol/LD.Ca2+ 0.1 mol/L
【答案】C
【解析】
根据溶液中电荷守恒判断M离子的电性, c (Cl) +2c (SO42-) =0.2mol/L+2×0.4mol/L=1mol/L,3c (Al3+)+c (H+)=3×0.1mol/ L+0.3mol/L=0.6mol/L,所以M为阳离子,令M阳离子为c (Mn+) ,根据电荷守恒有nc (Mn+) =1mol/L-0.6mol/L=0.4mol/L,再结合选项考虑离子共存判断。
根据溶液中电荷守恒判断M离子的电性, c (Cl) +2c (SO42-) =0.2mol/L+2×0.4mol/L=1mol/L,3c (Al3+)+c (H+)=3×0.1mol/ L+0.3mol/L=0.6mol/L,所以M为阳离子,令M阳离子为c (Mn+) ,根据电荷守恒有nc (Mn+) =1mol/L-0.6mol/L=0.4mol/L,
A、由上述分析可知,M为阳离子,不可能是CO32-,故A错误;
B、1×c (Na+) =0.3 mol/L,故B错误;
C、2×c (Zn2+)=2×0.2 mol/L=0. 4mol/L,故C正确;
D、2×c (Ca2+)=2×0.1 mol/ L=0.2mol/L,但硫酸根离子与钙离子不能共存,故D错误;
故选C。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
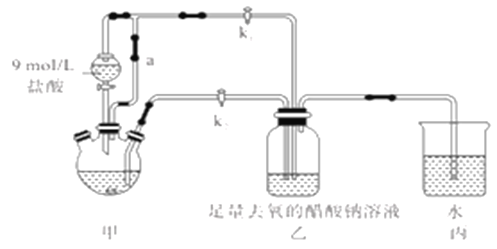
①检查装置气密性,往三颈烧瓶中依次加入过量锌粉,200mL0.200mol/LCrC13溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶內的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中。当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到11.28g[Cr(CH3COO)2]2·2H2O
(1)装置甲中连通管a的作用是________,如何检验甲装置的气密性是否良好?__________。
(2)生成红棕色晶体的离子反应方程式____________________________。
(3)步骤③中溶液自动转移至装置乙中的实验操作为________________。
(4)装置丙的作用是________________。
(5)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚 ②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(6)本实验中[Cr(CH3COO)2]2·2H2O的产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐含有泥沙以及Ca2+、Mg2+、SO42﹣等杂质,其提纯过程一般经过以下流程:

某兴趣小组按上述方案进行粗盐提纯实验,实验室提供了粗盐样品、稀盐酸、NaOH溶液、BaCl2溶液、Na2CO3溶液等药品以及必备的实验仪器若干。请回答下列问题:
(1)操作①粗盐样品加水之前,需要将大颗粒粗盐变为细小颗粒或粉末,此时在实验室中需要用到的仪器为__________。
(2)操作②、④过滤后的滤液仍有浑浊,需要进行的操作是___________________。
(3)操作③按abc顺序依次加入过量的试剂。若a为NaOH溶液,则c为________。加入c发生反应的离子方程式为_________________________________________________。
(4)加盐酸调溶液pH的目的是________________________________。
(5)步骤⑥操作名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学需用480 mL 0.5 mol·L-1Na2CO3溶液,在实验室进行配制。
I.(1)该同学用托盘天平应称量________g Na2CO3粉末,使用容量瓶前必须进行的一步操作是______。
(2)下图是该同学配制的一些关键步骤和操作图。
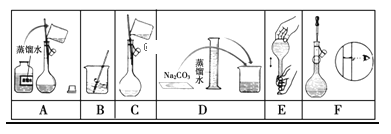
配制过程的先后顺序为(用字母A~F填写)________________。
Ⅱ.若配制1mol/L的稀硫酸溶液500mL
(1)则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL 、25mL、50mL量筒,应选用_____________mL规格的量筒最好。
(2)下面操作造成所配稀硫酸溶液浓度偏高的是(_____)
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO![]() 完全沉淀;若加入足量强碱并加热(
完全沉淀;若加入足量强碱并加热(![]() ,假设氨气全部逸出)可得到c mol NH3,则原溶液中的Al3+浓度为
,假设氨气全部逸出)可得到c mol NH3,则原溶液中的Al3+浓度为
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列5种离子中的某几种:![]() 。为确认溶液组成进行如下实验:
。为确认溶液组成进行如下实验:
(1)取1L上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀6.63g。向沉淀中加入过量的盐酸,有4.66g沉淀不溶。
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体2.24L(已换算成标准状况,假定产生的气体全部逸出)。
已知:①![]() ②NH3是一种极易溶于水的碱性气体
②NH3是一种极易溶于水的碱性气体
由此可以得出关于原溶液组成的正确结论是
A.![]()
B.如果上述5种离子都存在,则![]()
C.一定存在![]() ,一定不存在K+
,一定不存在K+
D.一定存在![]() ,可能存在
,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
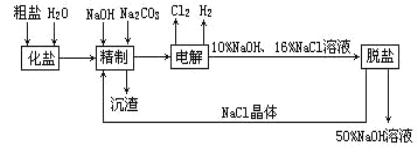
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为_______;与电源负极相连的电极附近,溶液pH______(选填:不变、升高或下降)。
(2)如果粗盐中SO42-含量较高,必须加钡剂除去,该钡试剂可以是______
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为______、_______
(4)电解饱和食盐水的总反应化学方程式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素 A、B、C、D、E 的最高价氧化物对应的水化物分别为 X、Y、M、Z、W,B 是短周期主族元素中原子半径最大的元素,常温下 X、Y、Z、W 均可与 M 反应,A、B、D、E 的原子序数及其对应 0.1mol/L X、Y、Z 、W 溶液的 pH 如图所示。
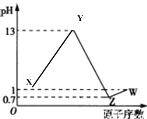
下列说法正确的是:
A. D的简单气态氢化物的热稳定性大于E的气态氢化物热稳定性
B. A、B、C 三种元素简单离子半径的大小顺序为C>B>A
C. Y 的稀溶液与 Z 或 W 的稀溶液分别发生中和反应时,对应的中和热在数值上相等
D. Y与W 两物质的化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com