尿素(H
2NCONH
2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH
3(l)+CO
2(g)?H
2O(l)+H
2NCONH
2 (l)△H=-103.7kJ?mol
-1试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是
.
A.采用高温 B.采用高压 C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH
3(l)+CO
2(g)?H
2NCOONH
4(氨基甲酸铵)(l)△H
1第二步:H
2NCOONH
4(l)?H
2O(l)+H
2NCONH
2(l)△H
2某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
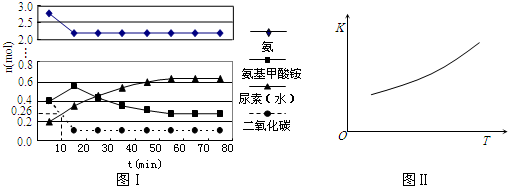
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第
步反应决定,总反应进行到
时到达平衡.
②反应进行到10 min时测得CO
2的物质的量如图所示,则用CO
2表示的第一步反应的速率
v(CO
2)=
.
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△
H20(填“>”“<”或“=”)




 备战中考寒假系列答案
备战中考寒假系列答案